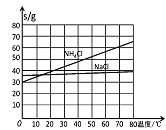
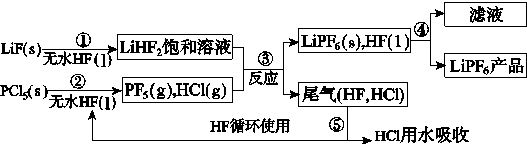
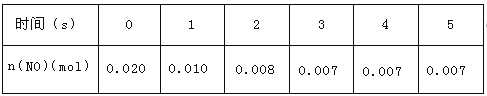
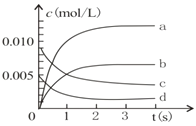
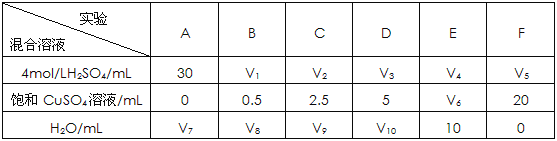
题目内容
【题目】[化学——选修3:物质结构与性质] X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态;M为元素周期表1~36号元素中电负性最小的元素,W元素基态原子的价电子构型为3d74s2;R位于周期表第11列。回答下列问题(若需表示具体元素必须用相应的元素符号):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是_____________(用元素符号表示),Y的最简单气态氢化物在水中的溶解度远大于X的最简单气态氢化物,主要原因是____________。
(2)R元素基态原子的电子排布式为_______。Z、M形成化合物M2Z2的电子式为_________。
(3)X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是_________,提供孤对电子的是__________________(填化学式)。
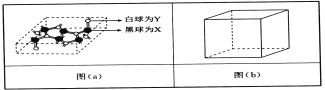
(4)已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石。该化合物的化学式为_____,其晶体类型为______,晶体中X、Y两种元素原子的杂化方式均为___________。
(5)在图(b)中标出R晶体中R原子的位置,该晶体中R原子直径为a pm,R的相对原子质量为M,阿伏加德罗常数为NA,该晶胞密度表达式为___________g·cm-3(用a,M,NA表示)。
【答案】(1)N>O>C;NH3与H2O两者均为极性分子,分子间存在氢键;
(2)1s22s22p63s23p63d104s1;![]()
(3)Co;CO (4)C3N4;原子晶体;sp3 (5)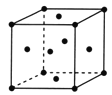 ;
;![]()
【解析】
试题分析:X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态,因此Y是N,则X是C,Z是O;M为元素周期表1~36号元素中电负性最小的元素,这说明M是金属性最强的K;W元素基态原子的价电子构型为3d74s2,所以原子序数是27,则W是Co;R位于周期表第11列,因此R是Cu。
(1)非金属性越强,第一电离能越大,氮元素的2p轨道处于半充满状态,稳定性强,则X、Y、Z三种元素的第一电离能由大到小的顺序是N>O>C;由于NH3与H2O两者均为极性分子,分子间存在氢键,所以Y的最简单气态氢化物在水中的溶解度远大于X的最简单气态氢化物。
(2)铜元素的原子序数是29,则根据核外电子排布规律可知基态原子的电子排布式为1s22s22p63s23p63d104s1;Z、M形成化合物M2Z2是过氧化钾,含有离子键和非极性键的离子化合物,电子式为![]() 。
。
(3)X、Z、W三种元素可以形成橘红色易升华的固体配合物Co2(CO)8,Co原子存在空轨道,CO存在孤对电子,在该配合物中提供空轨道的是Co,提供孤对电子的是CO。
(4)已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石,这说明其晶体类型为原子晶体,C的最高价是+4价,N的最低价是-3价,则该化合物的化学式为C3N4;根据晶胞可知1个碳原子形成4个单键,1个氮原子形成3个单键,但氮原子还有1对孤对电子,所以晶体中X、Y两种元素原子的杂化方式均为sp3。
(5)铜是面心六方最密堆积,则晶胞的结构示意图为 。晶胞铜原子的个数是8×1/8+6×1/2=4,该晶体中R原子直径为a pm,则面对角线是2apm,所以晶胞边长是
。晶胞铜原子的个数是8×1/8+6×1/2=4,该晶体中R原子直径为a pm,则面对角线是2apm,所以晶胞边长是![]() ,体积是
,体积是![]() ,如果R的相对原子质量为M,阿伏加德罗常数为NA,根据
,如果R的相对原子质量为M,阿伏加德罗常数为NA,根据![]() 可知该晶胞密度表达式为
可知该晶胞密度表达式为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案