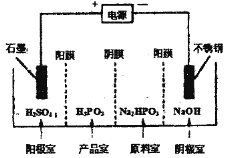
题目内容
【题目】[化学-选修2:化学与技术]碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:
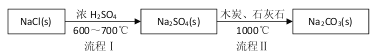
(1)流程I的另一产物是____,流程Ⅱ的反应分步进行:a. ![]()
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为__________________。
Ⅱ.1862年,比利时人索尔维(ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:
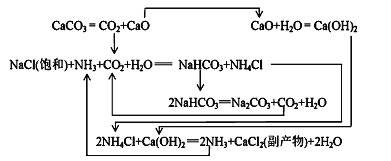
20℃时一些物质在水中的溶解度/g(100gH2O)
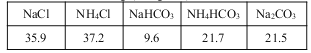
(2)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________。
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:_________、__________、_________。
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原
料利用率。
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在________(填温度范围)下析出________(填化学式)。
【答案】36.(1)HCl Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑
Na2CO3+CaS+4CO↑
(2)食盐、石灰石、NH3 CaO、NH3、CO2、NH4Cl
(3)反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大
(4) 0~10℃ NH4Cl
【解析】
试题分析:(1)根据流程图分析可知,反应物为NaCl(s)和浓硫酸,生成物是Na2SO4,利用的是难挥发性酸制挥发性酸,则流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C ![]() Na2S+4CO↑, b.Na2S与石灰石发生复分解反应,Na2S+CaCO3=Na2CO3+CaS,a+b即得总反应,所以总反应方程式可表示为Na2SO4+4C +CaCO3
Na2S+4CO↑, b.Na2S与石灰石发生复分解反应,Na2S+CaCO3=Na2CO3+CaS,a+b即得总反应,所以总反应方程式可表示为Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑。
Na2CO3+CaS+4CO↑。
(2)根据题给流程图可知,①在NH3饱和的NaCl液中通入CO2制得的NaHCO3和NH4Cl;②再将NaHCO3焙烧制得纯碱,CO2循环使用,③析出小苏打的母液(NH4Cl溶液)中加入生石灰,NH3循环使用。CO2由煅烧石灰石获得,所以氨碱法生成纯碱的原料是食盐、石灰石、NH3,石灰石煅烧生成CaO和CO2,CaO与水反应生成Ca(OH)2,Ca(OH)2 与NH4Cl反应生成氨气,所以可循环利用的物质有CaO、NH3、CO2、NH4Cl。
(3)根据题给信息,饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大。
(4)要想循环利用NH4Cl,根据溶解度—温度曲线,NH4Cl在0~10℃时溶解度最小,则向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃下析出NH4Cl。

【题目】(1).HNO3与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
Ⅰ | 1 ﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1 ﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1 ﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
制备NO气体最适宜的是: ,理由是: .
(2).兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:
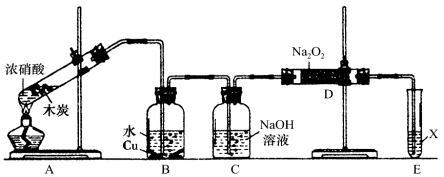
①组装好仪器后,必须进行的一项操作是:_________________。
②推测B中可以观察到的主要现象是:______;C装置的作用是: 。
③装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是:_____。可以通过适当改进,不产生Y物质,请你提出改进方法: _。
④E装置的实验目的是: 。
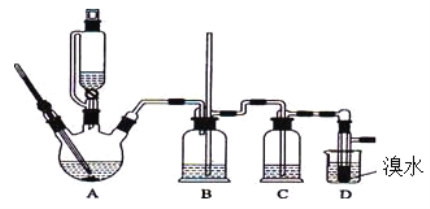
【题目】)实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 。
(2)装置B的作用是__________________________。
(3)在装置C中应加入 (填字母)。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 (填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是
。
(7)判断该制备反应已经结束的最简单方法是 。