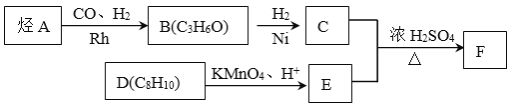
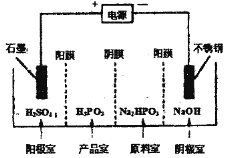
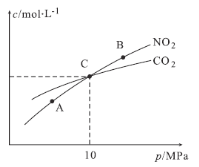
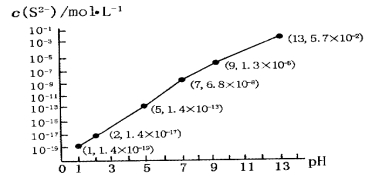
题目内容
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。X是同周期中金属性最强的元素,五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位置是 。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的微粒间作用力的类型为 。
(4)Z的氢化物与W的一种氢化物发生反应可生成Z的单质,写出其化学方程式 。
【答案】(1)第二周期ⅴA族;(2)Al(OH)3+ OH-= AlO2-+ 2H2O;
(3)![]() 离子键,共价键;(4)H2S+ H2O2 =S↓+ 2H2O.
离子键,共价键;(4)H2S+ H2O2 =S↓+ 2H2O.
【解析】试题分析:Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素,W、Z最外层电子数相同,但Z的核电荷数是W的2倍,W是O元素,Z是S元素,X是同周期中金属性最强的元素,X只能和S同周期,X是Na元素,根据五种元素核电荷数之和为55,对应原子最外层电子数之和为21可以推出Q是N元素,Y是Al元素;Q是N元素,位于元素周期表中第二周期ⅴA族,答案为:第二周期ⅴA族 ; (2)Na和Al各自的最高价氧化物对应的水化物可以发生反应生成盐和水,即NaOH和Al(OH)3反应生成偏铝酸钠和水,方程式为:Al(OH)3+ OH-= AlO2-+ 2H2O,答案为:Al(OH)3+ OH-= AlO2-+ 2H2O;(3)Na在氧气中燃烧生成过氧化钠,过氧化钠是由钠离子和过氧根离子构成的,含有离子键和非极性共价键,过氧化钠的电子式为:![]() ,答案为:
,答案为:![]() ,离子键,共价键;(4)H2S和H2O2反应生成S和水,反应的方程式为:H2S+ H2O2 =S↓+ 2H2O,答案为:H2S+ H2O2 =S↓+ 2H2O;
,离子键,共价键;(4)H2S和H2O2反应生成S和水,反应的方程式为:H2S+ H2O2 =S↓+ 2H2O,答案为:H2S+ H2O2 =S↓+ 2H2O;