题目内容
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是_______________(填两种物质的名称),其净水作用的原理是_______________________。
(2)水的净化与软化的区别是______________________________________。
(3)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol·L-1,c(Mg2+)=6×10-4mol·L-1,则此水的硬度为________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2_______g,后加入Na2CO3_______g。
(5)如图是电渗析法淡化海水的原理图,其中电极A接直流电源的正极,电极B接直流电源的负极。
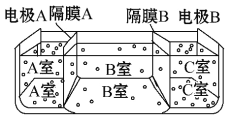
①隔膜A是________(填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl-以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为__________________________。
【答案】(1)明矾,硫酸铝,硫酸铁,硫酸亚铁(填写任意两种) 铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,可吸附天然水中悬浮物并破坏天然水中的其他带异电荷的胶体,使其聚沉以达到净水的目的
(2)水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是降低水中的钙离子和镁离子的含量(3)10°;(4)740;1484;(5) ①阴; ②pHa<pHb<pHc
【解析】
试题分析:(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2OAl(OH)3+3H+,明矾,硫酸铝,硫酸铁,硫酸亚铁也可以起到净水的作用,铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的;故答案为:明矾,硫酸铝,硫酸铁,硫酸亚铁,铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的;
(2)水的净化是除去悬浮性杂质,一般用明矾进行;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,故答案为:水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;
(3)某天然水中c(Ca2+)=1.2×10-3molL-1,c(Mg2+)=6×10-4molL-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=![]() +
+![]() =10°;故答案为:10°;
=10°;故答案为:10°;
(4)10m3这种天然水水中含有钙离子物质的量=10×103L×1.2×10-3molL-1=12mol;镁离子物质的量=10×103L×6×10-4molL-1=6mol;碳酸氢根离子物质的量=10×103L×8×10-4molL-1=8mol;加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
共需氢氧根物质的量20mol;
需要Ca(OH)2物质的量10mol,氢氧化钙质量为74g/mol×10mol=740g,
水溶液中Ca2+物质的量为12mol+10mol=22mol,
其中需要加入的 碳酸根离子为22mol-8mol=14mol,需要碳酸钠的质量为14mol×106g/mol=1484g,故答案为:740;1484;
(5)电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc;故答案为:阴,pHa<pHb<pHc

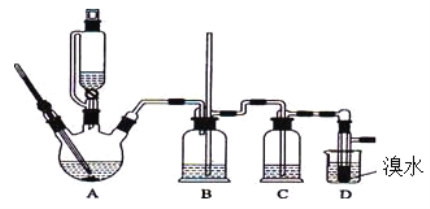
【题目】)实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 。
(2)装置B的作用是__________________________。
(3)在装置C中应加入 (填字母)。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 (填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是
。
(7)判断该制备反应已经结束的最简单方法是 。