题目内容
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究________________________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________(填序号)作对比。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-===2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液
③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸
⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂________(填序号),现象________________________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
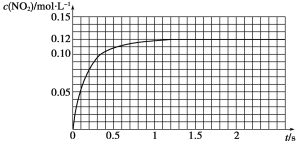
(1)反应容器中最后剩余的物质有________________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,从开始到平衡建立这段时间的平均反应速率为________。
【答案】Ⅰ.(1)H2O2的浓度(2)2 4 (3)>
Ⅱ.⑤ 溶液显血红色Ⅲ.(1)N2O4和NO2 0.004 (2)0.1mol/(L·s)
【解析】
试题分析:Ⅰ.(1)实验2和实验3主要是H2O2的浓度不一样,则实验2和实验3的目的是研究H2O2的浓度对化学反应速率的影响;
(2)实验2和实验4只有温度不同,则为研究温度对化学反应速率的影响,可以将实验2和实验4作对比;
(3)将实验1和实验2作对比,实验1无催化剂,实验2有催化剂,则实验1的化学反应速率小于实验2,则t1>t2;
Ⅱ.另取一份,加试剂⑤0.1 mol·L-1 KSCN溶液,若溶液出现血红色,则说明FeCl3没反应完,说明此反应为可逆反应;
Ⅲ.(1)由于该反应为可逆反应,则反应最后剩余的物质是N2O4和NO2,由图可知平衡时NO2的浓度是0.12mol/L,则平衡时的物质的量为0.012mol,可知分解的N2O4的物质的量为0.006mol,则剩余的N2O4的物质的量为0.01-0.006=0.004mol;
(2)从开始到平衡建立这段时间的平均反应速率为0.12/1.2=0.1mol/(L·s)。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案