题目内容
已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有 ;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是 ;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示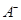 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。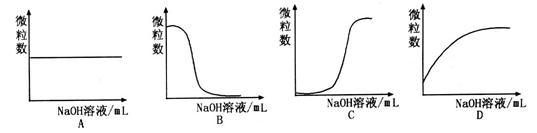
(2)现将1体积0.04mol 溶液和1体积0.02mol
溶液和1体积0.02mol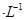 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其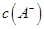 0.01 mol
0.01 mol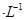 (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是 。
(1)①H2O、HA、H+、Na+、OH?、A-(2分,有错不得分)
②A-+H+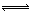 HA(2分,不写可逆号也可)
HA(2分,不写可逆号也可)
③D(1分)
(2)①<(1分)
②c(A-)>c(Na+)>c(H+)>c(OH?)(2分)
解析试题分析:(1)①溶液中的微观粒子既包括离子,也包括分子,所以含有HA和其钠盐NaA的溶液的微观粒子有:H2O、HA、H+、Na+、OH?、A-
②加入少量盐酸,HCl与NaA反应生成HA,所以离子方程式为:A-+H+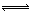 HA
HA
③溶液含有HA和NaA,逐滴加入NaOH溶液,HA与NaOH反应生成NaA和H2O,所以A2-数目逐渐增大,故D项正确。
(2)①1体积0.04mol/LHA溶液和1体积0.02mol/LNaOH溶液混合,HA过量,得到等量的NaA和HA,若该混合液显碱性,则c(H+)<c(OH?),根据电荷守恒c(H+)+c(Na+)=c(OH?)+c(A-)可得c(A-)<0.01mol?L?1。
②若该混合液显酸性,则HA的电离程度大于NaA的水解程度,溶液中所有离子的浓度由大到小的顺序是:c(A-)>c(Na+)>c(H+)>c(OH?)
考点:本题考查盐类的水解、弱电解质的电离、离子浓度比较。

已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 |
| C.Na2CO3 | D.NH3·H2O |
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?________。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________。
c(Na+)-c(A-)=________mol·L-1
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-、HB-
 H++B2-。
H++B2-。回答下列问题:
(5)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
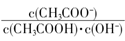 不变
不变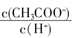 减小
减小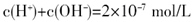

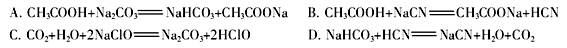

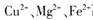 离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀,
离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀, (填“>”、“二”或“<”)。
(填“>”、“二”或“<”)。