题目内容
(14分)(1)常温时,将浓度为m mol· L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m n(填“>”、“<”或“=”,下同);若将PH=2的CH3COOH溶液和PH=12的NaOH溶液等体积混合,混合溶液的PH 7
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为
(4)常温时KSP[Cu(OH)2]= 2.2×10-20,将Cu(OH)2溶于2.2mol/LCuCl2溶液中形成平衡,溶解平衡方程式为 ,溶液的PH为
(5)物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl
⑥NH3·H2O。c(NH4+)由小到大的排列顺序是 (填序号)
⑴m > n;混合溶液的PH<7; ⑵Al3++3HCO3-=Al(OH)3↓+3CO2↑
⑶V2=100V1 或 (V1∶V2=1∶100) ⑷Cu(OH)2(s) Cu2+(aq)+2OH-(aq), pH =" 4" ;
Cu2+(aq)+2OH-(aq), pH =" 4" ;
⑸c(NH4+)由小到大的排列顺序是 ⑥<③<⑤<④<①<②
解析试题分析:(1)由于CH3COOH是弱酸,而NaOH是强碱,若二者等体积混合,混合后溶液的pH=7,则必须是酸要过量一些。因此m>n。若将PH=2的CH3COOH溶液,c(H+)=10-2mol/L;由于醋酸是弱酸,所以c(HAc)> 10-2mol/L, PH=12的NaOH溶液,c(OH-)=10-2mol/L;NaOH是强碱,c(NaOH)= c(OH-)=10-2mol/L,若二者等体积混合,由于酸过量所以混合溶液的PH<7。(2)硫酸铝溶液和碳酸氢钠溶液反应的两种方程式是:Al3++3HCO3-=Al(OH)3↓+3CO2↑;(3)常温下某强酸溶液pH=a,c(H+)=10-amol/L;强碱溶液pH=b,c(OH-)=10-14÷10-b=10-(14-b),已知a+b=12,酸碱溶液混合pH=7,V1×10-a = V2·10-(14-b). V1: V2=10-(14-b: 10-a=10-2=1:100。(4) Cu(OH)2难溶于水。但是物质再难溶解,也存在一定的溶解度,在溶液中存在沉淀溶解平衡。Cu(OH)2的沉淀溶解平衡方程式是Cu(OH)2(s) Cu2+(aq)+2OH-(aq) ;c(Cu2+) ="2.2mol/L." KSP[Cu(OH)2]= c(Cu2+)·c2(OH-)= 2.2×10-20,所以c2(OH-)= 2.2×10-20÷2.2=1.0×10-20。因此c(OH-) =1.0×10-10。C(H+)=10-4mol/L。所以pH=4。(5)①(NH4)2CO3和②(NH4)2SO4每个物质能电离产生2个NH4+;而③NH4HCO3、④NH4HSO4、⑤NH4Cl 每种只能电离产生1个NH4+;因此c(NH4+)①和②一定大于③④⑤的。②(NH4)2SO4中只有NH4+离子水解,要消耗;①(NH4)2CO3中铵根离子水解使溶液显酸性,CO32-水解使溶液显碱性,二者相互促进,使NH4+的水解程度比②的小。即c(NH4+):①<②;⑤在NH4Cl中NH4+的水解使溶液显酸性,铵根离子水解消耗;④NH4HSO4电离方程式是:NH4HSO4= NH4++H++ SO42-。电离产生的H+对NH4+的水解起抑制作用,使铵根离子的浓度比⑤大,即⑤<④。③NH4HCO3电离产生的离子都发生水解反应,水解相互促进,所以消耗的铵根离子较多,因此铵根离子的浓度比⑤小。⑥NH3·H2O是弱电解质,电离产生的两种浓度原小于盐电离产生的铵根离子的浓度。因此c(NH4+)由小到大的排列顺序是 ⑥<③<⑤<④<①<②
Cu2+(aq)+2OH-(aq) ;c(Cu2+) ="2.2mol/L." KSP[Cu(OH)2]= c(Cu2+)·c2(OH-)= 2.2×10-20,所以c2(OH-)= 2.2×10-20÷2.2=1.0×10-20。因此c(OH-) =1.0×10-10。C(H+)=10-4mol/L。所以pH=4。(5)①(NH4)2CO3和②(NH4)2SO4每个物质能电离产生2个NH4+;而③NH4HCO3、④NH4HSO4、⑤NH4Cl 每种只能电离产生1个NH4+;因此c(NH4+)①和②一定大于③④⑤的。②(NH4)2SO4中只有NH4+离子水解,要消耗;①(NH4)2CO3中铵根离子水解使溶液显酸性,CO32-水解使溶液显碱性,二者相互促进,使NH4+的水解程度比②的小。即c(NH4+):①<②;⑤在NH4Cl中NH4+的水解使溶液显酸性,铵根离子水解消耗;④NH4HSO4电离方程式是:NH4HSO4= NH4++H++ SO42-。电离产生的H+对NH4+的水解起抑制作用,使铵根离子的浓度比⑤大,即⑤<④。③NH4HCO3电离产生的离子都发生水解反应,水解相互促进,所以消耗的铵根离子较多,因此铵根离子的浓度比⑤小。⑥NH3·H2O是弱电解质,电离产生的两种浓度原小于盐电离产生的铵根离子的浓度。因此c(NH4+)由小到大的排列顺序是 ⑥<③<⑤<④<①<②
考点:考查电解质的电离、盐的水解、酸碱混合溶液的pH的计算及离子浓度的大小比较的知识。

硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: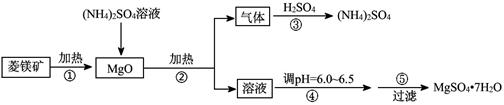
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | | | |
| 平衡移动方向 | | | |
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH(C6H5OH相当于一元弱酸):
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O。若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______________(填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa―→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa―→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol·L-1的下列六种物质的溶液中,pH最小的是________(填编号);其pH等于________(填数值);pH最大的是________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO
⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体根据上述反应,总结出复分解反应发生的另一规律___________________________________________
将KI溶液和AgCl固体混合搅拌,会观察到的现象是____________________________________,请写出反应的离子方程式______________________________________________

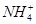 )由大到小的顺序为________;
)由大到小的顺序为________;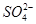 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(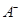 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。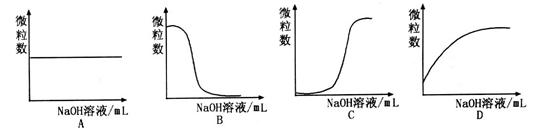
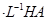 溶液和1体积0.02mol
溶液和1体积0.02mol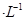 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。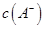 0.01 mol
0.01 mol