题目内容
Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?________。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________。
c(Na+)-c(A-)=________mol·L-1
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-、HB-
 H++B2-。
H++B2-。回答下列问题:
(5)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(1)a=7时,HA是强酸;a>7时,HA是弱酸 (2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+) (4)10-4-10-10
(5)AC
解析

练习册系列答案
相关题目
在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | | | |
| 平衡移动方向 | | | |
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
现有浓度均为0.1 mol·L-1的下列溶液:
①硫酸、②醋酸溶液、③氢氧化钠溶液、④氯化铵溶液、⑤醋酸铵溶液、⑥硫酸铵溶液、⑦硫酸氢铵溶液、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
| A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+) |
| B.c(Na+)=0.1 mol·L-1 |
| C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-) |
| D.c(H+)>c(OH-) |
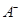 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。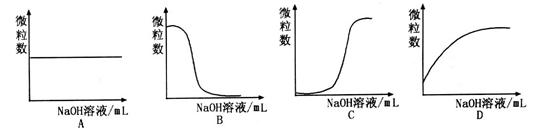
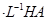 溶液和1体积0.02mol
溶液和1体积0.02mol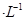 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。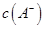 0.01 mol
0.01 mol
 。
。