题目内容
按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为
(2)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是 。
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C.溶液中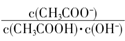 不变
不变
D溶液中 减小
减小
(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.lmol/L的下列五种溶液的PH值如表所示:
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。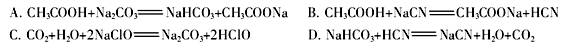
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度 离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀,
离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀, (填“>”、“二”或“<”)。
(填“>”、“二”或“<”)。
(1)c(Na+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+);(2)CD;(3)①1∶1;②AD;(4)①A;②AB;(5)Cu2+,<。
解析试题分析:(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液为等浓度的碳酸钠和碳酸氢钠的混合液,水解显碱性,且碳酸根的水解程度大于碳酸氢根,各离子浓度由大到小的顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+);(2)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释,醋酸的电离平衡正向移动,A、溶液中导电粒子的数目增多,错误;B、醋酸的电离程度增大,但溶液的体积增大,c(H+)减小,错误;C、加水稀释,溶液的温度不变,醋酸的电离常数和水的离子积常数不变,溶液中Ka/kw=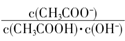 不变,正确;D、加水稀释,溶液中水的电离程度增大,溶液中
不变,正确;D、加水稀释,溶液中水的电离程度增大,溶液中 减小,正确;(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则有(0.3V1-0.1V2)·10-3=0.1(V1+V2)·10-3,可得V1∶V2=1∶1;②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得, A.若反应后溶液呈中性,则溶液中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,正确;B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,错误;C.若反应后溶液呈酸性,则溶液是酸和盐溶液,若酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,错误;D.若反应后溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,正确;选AD;(4)根据题给数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,溶液的碱性越强判断,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCN>HCO3—,①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是HCN,选A;②根据强酸制弱酸规律判断,下列反应可以成立的是AB;(5)当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,溶液中氢氧根的浓度逐渐增大,所需氢氧根浓度越小的离子越先沉淀,即pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2]。
减小,正确;(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则有(0.3V1-0.1V2)·10-3=0.1(V1+V2)·10-3,可得V1∶V2=1∶1;②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得, A.若反应后溶液呈中性,则溶液中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,正确;B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,错误;C.若反应后溶液呈酸性,则溶液是酸和盐溶液,若酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,错误;D.若反应后溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,正确;选AD;(4)根据题给数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,溶液的碱性越强判断,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCN>HCO3—,①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是HCN,选A;②根据强酸制弱酸规律判断,下列反应可以成立的是AB;(5)当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,溶液中氢氧根的浓度逐渐增大,所需氢氧根浓度越小的离子越先沉淀,即pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2]。
考点:考查电解质溶液,涉及弱电解质的电离、盐类的水解及沉淀溶解平衡。

 新思维寒假作业系列答案
新思维寒假作业系列答案物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |

(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=________。(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题:
①若该水溶液由0.1 mol·L-1 HA溶液与0.1 mol·L-1NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是________。
③若该溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是______________(填编号);
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________;
A.c(H+) B.
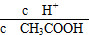 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.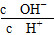
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图:则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是__________________________________________,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:____________________________________;
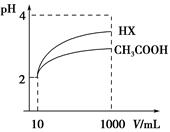
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 ( )。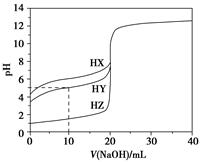
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
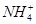 )由大到小的顺序为________;
)由大到小的顺序为________;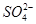 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(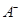 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。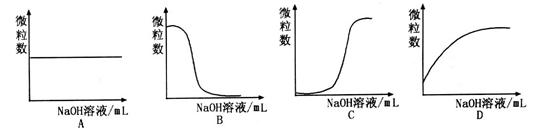
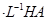 溶液和1体积0.02mol
溶液和1体积0.02mol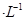 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。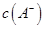 0.01 mol
0.01 mol