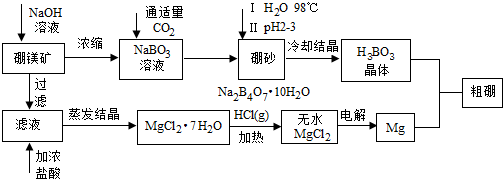
题目内容
5.(1)下列物质变化,只与氢键有关的是BCD.(填字母序号)A.干冰熔化 B.乙酸汽化 C.乙醇与丙酮混溶 D.
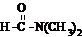 溶于水
溶于水 E.碘溶于四氯化碳 F.石英熔融
(2)下列物质中,只含有极性键的分子是BC(均填字母序号),既含离子键又含共价键的化合物是G,只存在σ键的分子是CE,同时存在σ键和π键的分子是ABD.
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(3)用“>”“<”“=”填空:
第一电离能的大小:Mg>Al;电负性的大小:As<Br.
分析 (1)A.干冰熔化克服的分子间作用力;
B.乙酸汽化,克服分子与分子之间的氢键;
C.乙醇与丙酮混溶,分子与分子间存在氢键;
D.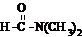
E.碘溶于四氯化碳,相似相溶;
F.石英熔融,克服共价键;
(2)非金属元素的原子之间通常形成共价键,不同种非金属元素原子之间通常形成极性键,同种非金属元素原子之间形成非极性键,活泼金属和活泼非金属元素之间易形成离子键;
只含共价键的化合物是共价化合物,离子键为阴阳离子之间形成的化学键,离子化合物中一定含有离子键,可能含有共价键;
只存在共价单键的分子中只含σ键,含有双键、三键的分子中存在σ键和π键;
(3)同周期从左到右第一电离能依次增大,但是在第IIA、ⅤA族出现特殊性;同一周期元素中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减弱,所以元素的非金属性越强,其电负性越大,元素的金属性越强,其电负性越小,据此分析解答.
解答 解:(1)A.干冰熔化克服的分子间作用力;
B.乙酸汽化,克服分子与分子之间的氢键;
C.乙醇与丙酮混溶,分子与分子间存在氢键;
D.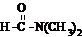
E.碘溶于四氯化碳,相似相溶;
F.石英熔融,克服共价键;
所以与氢键有关的是BCD,
故答案为:BCD;
(2)A.N2分子含有非极性共价键,属于单质,氮气分子结构简式为N≡N,所以氮气分子中含有σ键和π键;
B.CO2分子中碳原子和氧原子之间存在极性键,属于共价化合物,二氧化碳分子结构简式为O=C=O,所以二氧化碳分子中含有σ键和π键;
C.CH2Cl2分子中碳原子和氢原子或氯原子之间存在极性键,属于共价化合物,CH2Cl2分子结构式为: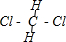 ,CH2Cl2分子中只含σ键;
,CH2Cl2分子中只含σ键;
D.C2H4分子中碳原子和氢原子之间存在极性键,碳原子和碳原子之间存在非极性共价键,属于共价化合物,乙烯的结构式为 ,乙烯分子中含有σ键和π键;
,乙烯分子中含有σ键和π键;
E.C2H6分子中碳原子和氢原子之间存在极性键,碳原子和碳原子之间存在非极性共价键,属于共价化合物,乙烷的结构式为 ,乙烷分子中只含σ键;
,乙烷分子中只含σ键;
F.CaCl2中只含离子键,属于离子化合物;
G.NH4Cl中铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在共价键,属于离子化合物,铵根离子中氮原子和氢原子之间存在σ键;
故答案为:BC;G;CE;ABD;
(3)同周期从左到右第一电离能依次增大,但镁,铝特殊,理由是镁的价电子排布是3s2,3p轨道全空较稳定,而铝是3s23p1则不是全满,全空,半空中任意一种情况,不稳定,故铝的第一电离能比镁小;非金属性Br>As,所以电负性,Br>As,故答案为:>;<.
点评 本题考查了化学键类型的判断,题目难度中等,注意离子键与共价键的区别,注意电离能和电负性的变化趋势,比较容易.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O22-与S2-具有相同的质子数和电子数 | |
| C. | 所有主族元素的简单离子所带电荷数与其族序数相等 | |
| D. | 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,LiH、LiD、LiT的化学性质不同 |
| A. | 溶液中水电离出的H+个数:②>① | |
| B. | ①溶液中阴离子的总浓度小于0.01 mol•L-1 | |
| C. | ②溶液中:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+) | |
| D. | ②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| A. | 含有非极性共价键的化合物分子一定是非极性分子 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 冰主要是水分子通过氢键作用而形成的分子晶体 | |
| D. | 若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q |
| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
| A. | 3,3-二甲基-2-戊烯 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-2-戊烯 | D. | 2,2-二甲基丁烷 |