题目内容
13.有关①100mL0.01 mol•L-1Na2CO3、②10mL0.1 mol•L-1Na2CO3两种溶液的叙述正确的是( )| A. | 溶液中水电离出的H+个数:②>① | |
| B. | ①溶液中阴离子的总浓度小于0.01 mol•L-1 | |
| C. | ②溶液中:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+) | |
| D. | ②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
分析 A.浓度越稀水解程度越大,所以①水解程度大于②,而水电离出的氢离子和氢氧根离子的物质的量相等,据此判断溶液中水电离出的H+个数;
B.①溶液中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,导致阴离子难度增大;
C.根据碳酸钠溶液中的质子守恒判断;
D.水解是微弱的,所以离子浓度大小关系是c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3).
解答 解:A.离子浓度越稀水解程度越大,所以①水解程度大于②,而水电离出的氢离子和氢氧根离子的物质的量相等,所以溶液中水电离出的H+个数:①>②,故A错误;
B.①溶液中,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,导致阴离子的浓度增大,即:阴离子的总浓度大于0.01 mol•L-1,故B错误;
C.根据碳酸钠溶液中的质子守恒可知:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+),故C正确;
D.水解是微弱的,所以离子浓度大小关系是c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3),故D错误;
故选C.
点评 本题考查离子浓度大小的比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:

已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①需要加快反应速率,措施有充分搅拌和加热、适当增加盐酸浓度等(写一种).碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是A
A.50~60℃B.80~100℃C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①需要加快反应速率,措施有充分搅拌和加热、适当增加盐酸浓度等(写一种).碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是A
A.50~60℃B.80~100℃C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.
4.下列物质中,既有离子键,又有共价键的是( )
| A. | CaCl2 | B. | Na2O | C. | H2SO4 | D. | NH4Cl |
8.变黑的银器可根据电化学原理进行翻新,其方法如下:在铝制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后黑色会褪去,该反应的化学方程式为:2Al+3Ag2S+6H2O=6Ag+3H2S↑+2Al(OH)3.下列关于说法正确的是( )
| A. | 正极反应式:Al-3e-+3H2O=Al(OH)3+3H+ | |
| B. | 放电过程中,Cl-向正极移动 | |
| C. | 每转移0.2mol电子,理论上生成0.1molH2S气体 | |
| D. | 处理过程中银器一直保持恒重 |
18.C、N、O、Al、Fe、Cu是常见的六种元素.
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
(3)10g铁放在40mL硝酸溶液中,微热,充分反应后收集到1.792L(标准状况)混合
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
2.下列实验中,反应速率加快属于由催化剂引起的是( )
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
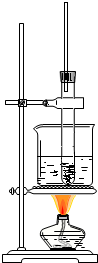 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下: 溶于水
溶于水