题目内容
14.铁及铁的化合物应用广泛,如FeCl3可用作催化剂.印刷电路铜板腐蚀剂和外伤止血剂等.(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)若将(1)中的反应设计成原电池,负极材料是Cu,电解液是FeCl3溶液,正极电极反应式为Fe3++e-=Fe2+.
分析 (1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液.
解答 解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,
故答案为:Cu;FeCl3溶液; Fe3++e-=Fe2+.
点评 本题考查学生原电池的构成条件、工作原理以及燃料电池的工作原理知识,注重基础知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列物质中,既有离子键,又有共价键的是( )
| A. | CaCl2 | B. | Na2O | C. | H2SO4 | D. | NH4Cl |
2.下列实验中,反应速率加快属于由催化剂引起的是( )
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
9.为说明氯比硫的非金属性强,下列事实可作依据的是( )
| A. | HCl的溶解性强于H2S | B. | 氯的最高价为+7价 | ||
| C. | HCl的稳定性强于H2S | D. | HClO的氧化性强于H2SO4 |
19.下列有关乙醇和苯酚的说法中不正确的是( )
| A. | 乙醇和苯酚均无毒,但都能用于消毒、杀菌 | |
| B. | 乙醇和苯酚均能和金属Na反应置换出氢气 | |
| C. | 苯酚能与甲醛反应制造酚醛树脂 | |
| D. | 乙醇的沸点比乙烷高是因为乙醇分子间可以形成氢键 |
6.在100mL1mol•L-1 AlCl3溶液中滴加1mol•L-1NaOH溶液,得到3.9g沉淀,则加入的NaOH溶液的体积可能是( )
| A. | 160mL | B. | 200mL | C. | 300mL | D. | 350mL |
4.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 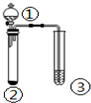 |
| A | 稀盐酸 | Na2S | 漂粉精溶液 | 酸性:盐酸>氢硫酸>次氯酸 | |
| B | 浓盐酸 | KMnO4 | Na2S溶液 | 氧化性:KMnO4>Cl2>S | |
| C | 浓氨水 | NaOH | 酚酞 | 碱性:NaOH>NH3•H2O | |
| D | 浓硫酸 | Na2SO3 | BaCl2溶液 | SO2与可溶性钡盐均不反应 |
| A. | A | B. | B | C. | C | D. | D |
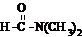 溶于水
溶于水