题目内容
【题目】硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
(1)Ⅰ.研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示.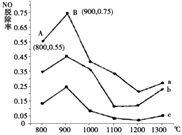
①曲线a中,NO的起始浓度为6×10﹣4 mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为mg/(m3s).
②曲线b对应的NH3与NO的物质的量之比是 , 其理由是 .
③已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol
请写出用NH3脱除NO的热化学方程式
(2)Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下(Ce为铈元素):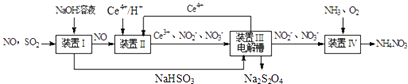
①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为 .
②装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如右图所示.其阴极的电极反应式为 . 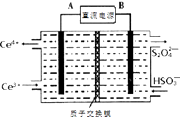
③按上述流程处理含有a mol SO2、b mol NO的雾霾(b>a),并制取Na2S2O4和NH4NO3 . 装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3﹣和Ce3+、装置Ⅳ中NO2﹣均全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2L.(用含a、b的代数式表示)
【答案】
(1)1.5×10﹣4;3:1;NH3与NO的物质的量的比值越大,NO脱除率越大;4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070kJ/mol
(2)3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+;2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O;5.6(3b﹣a)
【解析】解:(1)Ⅰ.①曲线a中,NO的起始浓度为6×10﹣4mg/m3 , A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8 s,该时间段内NO的脱除速率= ![]() =1.5×10﹣4mg/(m3s),所以答案是:1.5×10﹣4;②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,所以答案是:3:1;NH3与NO的物质的量的比值越大,NO脱除率越大;③已知在25℃,101kPa时:①N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol③N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol利用盖斯定律,将②×3﹣①×2﹣③×3可得4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol, 所以答案是:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol;(2)Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2﹣、NO3﹣等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4 , NO2﹣、NO3﹣等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+ , 所以答案是:3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+;②阴极发生还原反应,电极方程式为2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O,所以答案是:2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O;③amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3 , S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,由化合价升降总数相等可知4x+a=3b,x=
=1.5×10﹣4mg/(m3s),所以答案是:1.5×10﹣4;②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,所以答案是:3:1;NH3与NO的物质的量的比值越大,NO脱除率越大;③已知在25℃,101kPa时:①N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol③N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol利用盖斯定律,将②×3﹣①×2﹣③×3可得4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol, 所以答案是:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol;(2)Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2﹣、NO3﹣等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4 , NO2﹣、NO3﹣等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+ , 所以答案是:3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+;②阴极发生还原反应,电极方程式为2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O,所以答案是:2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O;③amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3 , S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,由化合价升降总数相等可知4x+a=3b,x= ![]() ,则氧气的体积为
,则氧气的体积为 ![]() mol×22.4L/mol=5.6(3b﹣a)L,所以答案是:5.6(3b﹣a).
mol×22.4L/mol=5.6(3b﹣a)L,所以答案是:5.6(3b﹣a).
【考点精析】关于本题考查的反应热和焓变和化学平衡的计算,需要了解在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.