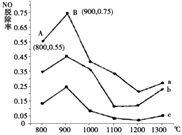
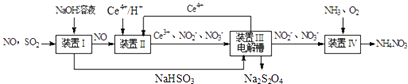
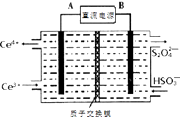
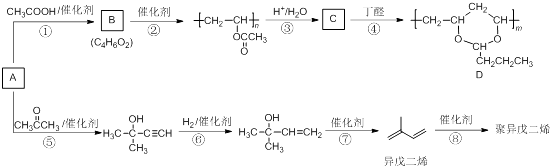
题目内容
【题目】向体积为2L的密闭容器中加入2molSO2和1molO2 , 进行可逆反应2SO2+O22SO3 反应2min后,测得O2的物质的量为0.8mol,则加热
(1)2min内,SO2的物质的量减少了 , SO3的物质的量增加了
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
【答案】
(1)0.4mol;0.4mol
(2)0.05mol/(L?min)
(3)0.1mol/(L?min)
【解析】解:(1)反应2min后,测得O2的物质的量为0.8mol,则氧气的物质的量变化为:1mol﹣0.8mol=0.2mol,根据反应方程式2SO2+O22SO3可知,二氧化硫减少的物质的量为:0.2mol×2=0.4mol,三氧化硫增加的物质的量为:0.2mol×2=0.4mol,所以答案是:0.4mol;0.4mol;(2)用O2的浓度变化来表示该反应的反应速率为:v(O2)= ![]() =0.05mol/(Lmin),所以答案是:0.05mol/(Lmin);(3)反应速率之比等于化学计量数之比,则v(SO3)=2v(O2)=2×0.05mol/(Lmin)=0.1mol/(Lmin),所以答案是:0.1mol/(Lmin).
=0.05mol/(Lmin),所以答案是:0.05mol/(Lmin);(3)反应速率之比等于化学计量数之比,则v(SO3)=2v(O2)=2×0.05mol/(Lmin)=0.1mol/(Lmin),所以答案是:0.1mol/(Lmin).
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D