题目内容
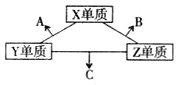
【题目】A、B、C、D四种短周期元素,原子半径逐渐减小,A与C的核电荷数之比为3: 4,能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A. X、Y、Z的稳定性逐渐减弱
B. X、Y、Z三种化合物的熔沸点逐渐降低
C. A、B、C、D只能形成5种单质
D. 由A、B、C、D四种元素组成的化合物有很多种
【答案】D
【解析】A、B、C、D四种短周期元素的原子半径依次减小,A与C核电荷数之比为![]() 的两元素有Li和Be、C和O、F和Mg、Mg和S,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,可推知A为C元素,C为O元素,D为H元素,则B为N元素;X、Y、Z分别为
的两元素有Li和Be、C和O、F和Mg、Mg和S,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,可推知A为C元素,C为O元素,D为H元素,则B为N元素;X、Y、Z分别为![]() 、
、![]() 、
、![]() ;同周期随原子序数增大,非金属性增强,所以非金属性
;同周期随原子序数增大,非金属性增强,所以非金属性![]() ,非金属性越强,氢化物越稳定,所以
,非金属性越强,氢化物越稳定,所以![]() 、
、![]() 、
、![]() 的稳定性逐渐增强,A错误;氨气、水分子间有氢键,甲烷分子间没有氢键,熔沸点最低;水分子间氢键比氨气分子间氢键作用力大,所以
的稳定性逐渐增强,A错误;氨气、水分子间有氢键,甲烷分子间没有氢键,熔沸点最低;水分子间氢键比氨气分子间氢键作用力大,所以![]() 、
、![]() 、
、![]() 三种化合物的熔沸点逐渐增大,B错误;各元素都存在同位素,原子种数大于5种, C错误;四元素组成的化合物除常见的碳酸铵、碳酸氢铵外,有机物中硝基化合物、硝酸酯、氨基酸、蛋白质等均属于C、H、O、N组成的化合物;正确选项D。
三种化合物的熔沸点逐渐增大,B错误;各元素都存在同位素,原子种数大于5种, C错误;四元素组成的化合物除常见的碳酸铵、碳酸氢铵外,有机物中硝基化合物、硝酸酯、氨基酸、蛋白质等均属于C、H、O、N组成的化合物;正确选项D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
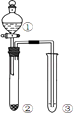
【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D