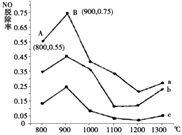
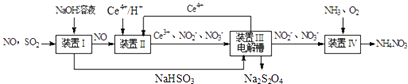
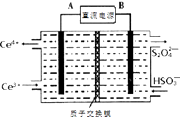
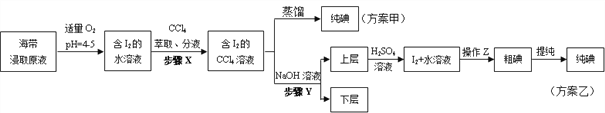
题目内容
【题目】工业上常用如下的方法从海水中提溴:浓缩海水 ![]() 粗产品溴
粗产品溴 ![]() 溴蒸气
溴蒸气 ![]() 物质X
物质X ![]() 产品溴,下列说法错误的是( )
产品溴,下列说法错误的是( )
A.步骤①的主要反应为:Cl2+2Br﹣→Br2+2Cl﹣
B.物质X为HBrO
C.步骤②③的目的是富集溴元素
D.步骤②利用了溴易挥发的性质
【答案】B
【解析】解:浓缩后增大溴离子的浓度,与氯气发生2Br﹣+C12=Br2+2Cl﹣ , 用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4 , ④中发生Cl2+2HBr=Br2+2HCl;A.步骤①中用氯气氧化海水的Br﹣ , 发生反应的离子方程式为2Br﹣+C12=Br2+2Cl﹣ , 故A正确;
B.步骤③中向溴水中通入SO2,发生的反应为Br2+2H2O+SO2═2HBr+H2SO4 , 则X为HBr,故B错误;
C.利用步骤②③达到富集溴元素的目的,故C正确;
D.利用溴易挥发,向浓缩经氯气氧化后的海水中空气和水蒸气可吹出溴蒸气,故D正确;
故选:B.
浓缩后增大溴离子的浓度,与氯气发生2Br﹣+C12=Br2+2Cl﹣ , 用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4 , ④中发生Cl2+2HBr=Br2+2HCl,以此来解答;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D