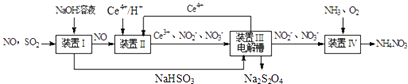
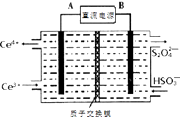
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA
B.制取标准状况下22.4 L Cl2 , 需转移的电子数为2NA
C.2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA
D.标准状况下3.36 L HF里含有的原子总数为0.3NA
【答案】C
【解析】解:A、5.6g铁的物质的量为n= ![]() =0.1mol,而铁和水蒸汽反应后变为+
=0.1mol,而铁和水蒸汽反应后变为+ ![]() 价,故0.1mol铁失去
价,故0.1mol铁失去 ![]() NA个电子,故A错误; B、制取氯气的反应中,氯元素的价态变化不明确,故当生成1mol氯气时,转移的电子数无法计算,故B错误;
NA个电子,故A错误; B、制取氯气的反应中,氯元素的价态变化不明确,故当生成1mol氯气时,转移的电子数无法计算,故B错误;
C、2.3g钠的物质的量为0.1mol,故反应后钠元素为+1价,故0.1mol钠失去0.1NA个,故C正确;
D、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量和原子个数,故D错误.
故选C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目