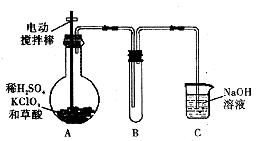
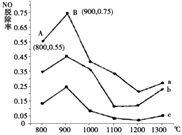
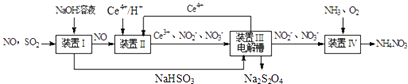
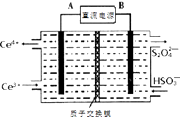
题目内容
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱. 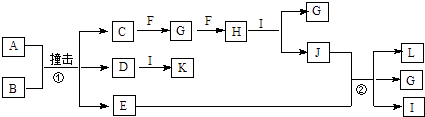
(1)F的化学式为 .
(2)K的电子式为 .
(3)写出反应①的化学方程式:
(4)写出反应②的离子方程式: .
【答案】
(1)O2
(2)![]()
(3)2NaN3+CuO ![]() Na2O+3N2↑+Cu
Na2O+3N2↑+Cu
(4)3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
【解析】解:C是空气中含量最多的单质,则C为N2 , D是白色粉末且焰色反应呈黄色,D中含有钠元素,I是最常见的液体,则I为H2O,K是一种强碱,D与I反应生成K,则K为NaOH,所以D为Na2O,E是一种紫红色金属,则E为Cu,A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , A、B反应生成C、D、E,结合元素守恒可知,A为CuO,B为NaN3 , F是一种无色气体单质,H是一种红棕色气体,则H为NO2 , 根据转化关系可知,F为O2 , G为NO,二氧化氮与水反应生成J为HNO3 , 硝酸和铜反应生成L为Cu(NO3)2 , (1)根据上面的分析可知,F的化学式为O2 , 所以答案是:O2;(2)K为NaOH,K的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)反应①的化学方程式为:2NaN3+CuO
;(3)反应①的化学方程式为:2NaN3+CuO ![]() Na2O+3N2↑+Cu, 所以答案是:2NaN3+CuO
Na2O+3N2↑+Cu, 所以答案是:2NaN3+CuO ![]() Na2O+3N2↑+Cu;(4)反应②为铜 与稀硝酸反应生成硝酸铜与一氧化氮,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,
Na2O+3N2↑+Cu;(4)反应②为铜 与稀硝酸反应生成硝酸铜与一氧化氮,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,
所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案