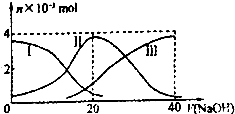
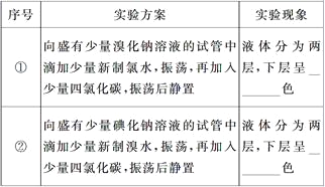
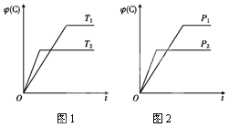
题目内容
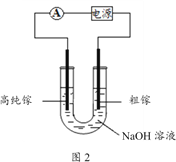
【题目】下图是氢氧燃料电池的示意图,按图中提示,下列叙述不正确的是( )

A. a电极是负极,b电极是正极
B. a电极的电极反应式为H2-2e-===2H+
C. b电极的电极反应式为4OH--4e-===2H2O+O2↑
D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内
【答案】C
【解析】A. 氢氧燃料电池,氢气在负极失电子发生氧化反应,氧气在正极得电子发生还原反应,a电极是负极,b电极是正极;B.氢气失电子,在负极发生氧化反应;C.氧气得电子,在正极发生还原反应;D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内新型发电装置。
氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气a电极是负极,b电极是正极,A正确;B. a电极为负极,发生氧化反应,H2-2e-===2H+,B正确;通入氧气的b电极为原电池的正极,发生还原反应,极反应式为:O2+4e-+2H2O=4OH-,C错误;氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,D正确;正确选项C。

【题目】工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数.下列说法正确的是 ( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2 , 达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
【题目】实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·5H2O),方案如下:

金属离子生成氢氧化物沉淀的pH可参考下列数据:
Fe3+ | Fe2+ | Cu2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 5.2 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 6.7 | 4.7 |
请回答:
(1)若溶解合金时加入的混酸由2 L 3 mol·L-1硫酸和1 L 2 mol·L-1硝酸混合而成,则反应后生成标准状况下的NO的体积最多为____________L。
(2)加入H2O2的目的是____________。
(3)为保证产品的纯度,M物质最好选用________(填字母),调节pH的范围为____________。
a.Cu(OH)2 b.H2SO4 c.NH3·H2O d.Na2CO3
(4)滤液D中加入硫酸的目的为_______________________________________。
(5)从溶液E制得CuSO4·5H2O晶体所需要的步骤为________、结晶、过滤和干燥。
(6)0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。试确定200℃时固体物质的化学式______________。