题目内容
【题目】加入0.1 mol MnO2粉末于50 mL过氧化氢溶液(ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

(1)实验时放出气体的总体积是_______________________________________。
(2)放出一半气体所需的时间为_________________________________________。
(3)反应放出3/4气体所需时间为_________________________________________________。
(4)A、B、C、D各点反应速率快慢的顺序为________________________________________。
(5)解释反应速率变化的原因是_______________________________________________。
(6)计算H2O2的初始物质的量的浓度________________________________________。
(7)求反应到2 min时,H2O2的质量分数_______________________________________。
【答案】 60 mL 1 min 2 min D>C>B>A 随着反应的进行,c(H2O2)逐渐降低,反应速率逐渐变慢 0.108 mol·L-1 0.086%
【解析】根据V-t图像知,反应进行到1min时,放出O2的体积为30mL,反应进行至2 min时,放出O2体积为45mL,反应进行至4 min时,放出O2的体积达最大值60mL;由V-t曲线的斜率变化可知:D、C、B、A的反应速率逐渐减小,这是因为随着反应的进行,c(H2O2)逐渐减小,反应速率逐渐变慢;根据2H2O2![]() 2H2O+O2↑,n(H2O2)=0.06×2/22.4mol,所以H2O2的起始物质的量浓度为[0.06×2/22.4]÷0.05=0.108 mol·L-1;反应进行至2 min时,消耗H2O2的物质的量为n′(H2O2)=0.045×2/22.4=0.004 mol,剩余H2O2的物质的量为0.06×2/22.4-0.045×2/22.4=1.34×10-3mol,所以w(H2O2)=
2H2O+O2↑,n(H2O2)=0.06×2/22.4mol,所以H2O2的起始物质的量浓度为[0.06×2/22.4]÷0.05=0.108 mol·L-1;反应进行至2 min时,消耗H2O2的物质的量为n′(H2O2)=0.045×2/22.4=0.004 mol,剩余H2O2的物质的量为0.06×2/22.4-0.045×2/22.4=1.34×10-3mol,所以w(H2O2)= ;根据以上分析解答。
;根据以上分析解答。
(1)由反应方程式为: 2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,最后阶段,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可以知道,生成氧气的体积为60 mL;正确答案: 60 mL 。
2H2O+O2↑,该反应为不可逆反应,最后阶段,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可以知道,生成氧气的体积为60 mL;正确答案: 60 mL 。
(2)由图象可以知道,当放出一半气体30 mL时,所需的时间为1 min;正确答案:1 min。
(3)由图象可以知道, 反应放出3/4气体的体积为45mL,所需时间为2 min ;正确答案:2 min。
(4)由曲线的变化特点可以看出,曲线的斜率逐渐变小,说明反应逐渐减慢,则反应速率D>C>B>A;正确答案是: D>C>B>A。
(5)根据图像可以知道,随着反应的进行,c(H2O2)逐渐降低,反应速率逐渐变慢;正确答案:随着反应的进行,c(H2O2)逐渐降低,反应速率逐渐变慢。
(6)根据2H2O2![]() 2H2O+O2↑,n(H2O2)=0.06×2/22.4mol,所以H2O2的起始物质的量浓度为[0.06×2/22.4]÷0.05=0.108 mol·L-1;正确答案:0.108 mol·L-1 。
2H2O+O2↑,n(H2O2)=0.06×2/22.4mol,所以H2O2的起始物质的量浓度为[0.06×2/22.4]÷0.05=0.108 mol·L-1;正确答案:0.108 mol·L-1 。
(7)反应进行至2 min时,消耗H2O2的物质的量为n′(H2O2)=0.045×2/22.4=0.004 mol,剩余H2O2的物质的量为0.06×2/22.4-0.045×2/22.4=1.34×10-3mol,所以w(H2O2)=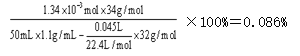 ;正确答案:0.086%。
;正确答案:0.086%。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】根据题意填空:
(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: .
(2)下表是几种常见弱酸的电离平衡常数(25℃)
酸 | H2CO3 | CH3COOH | HClO |
K | K1=4.4×10﹣7;K 2=4.7×10﹣11 | K=1.76×10﹣5 | K=2.95×10﹣8 |
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是 .
(3)常温下,将0.02molL﹣1 的 Ba(OH)2溶液100mL和0.02molL﹣1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为 .
(4)25℃时,Ksp[Mg(OH)2]=5.61×10﹣12 , Ksp[MgF2]=7.42×10﹣11 . 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,(填化学式)溶液中的 c(Mg2+)大.

