题目内容
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为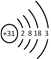 ,镓元素在周期表中的位置是_______。
,镓元素在周期表中的位置是_______。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是 ____________________________________。
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
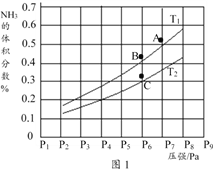
图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________。
(4)电解法可以提纯粗镓,具体原理如图2所示:
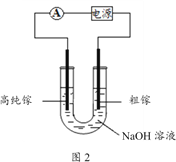
①粗镓与电源____极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________。
【答案】 第四周期第III A族 2Ga+6H2O ==== Ga(OH)3+3H2↑ Ga +NH3 ![]() GaN+3HCl 2 Ga(l)+2NH3(g)
GaN+3HCl 2 Ga(l)+2NH3(g) ![]() 2 GaN(s)+3H2(g) △H=—30.81kJ/mol KA< KC 其他条件一定时温度升高,平衡逆向移动,K减小 正 GaO2-+3e- +2H2O====Ga+4OH-
2 GaN(s)+3H2(g) △H=—30.81kJ/mol KA< KC 其他条件一定时温度升高,平衡逆向移动,K减小 正 GaO2-+3e- +2H2O====Ga+4OH-
【解析】(1) 根据镓(Ga)的原子结构示意图为 ,镓元素在周期表中的位置是第四周期第III A族;(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,反应的化学方程式是2Ga+6H2O =Ga(OH)3+3H2↑;(3)①GaCl3与NH3在一定条件下反应生成氮化镓(GaN),反应的化学方程式是Ga +NH3
,镓元素在周期表中的位置是第四周期第III A族;(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,反应的化学方程式是2Ga+6H2O =Ga(OH)3+3H2↑;(3)①GaCl3与NH3在一定条件下反应生成氮化镓(GaN),反应的化学方程式是Ga +NH3 ![]() GaN+3HCl;②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。则可逆反应的热化学方程式是2 Ga(l)+2NH3(g)
GaN+3HCl;②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。则可逆反应的热化学方程式是2 Ga(l)+2NH3(g) ![]() 2 GaN(s)+3H2(g) △H=—30.81kJ/mol;
2 GaN(s)+3H2(g) △H=—30.81kJ/mol;
③图中A点和C点化学平衡常数的关系是:KA< KC,理由是其他条件一定时温度升高,平衡逆向移动,K减小;(4)①电解法可以提纯粗镓,粗镓与电源正极相连作为阳极;②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电得电子产生=Ga,电极反应式是GaO2-+3e- +2H2O====Ga+4OH-。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案