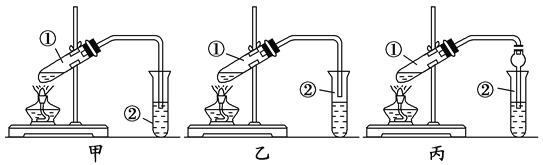
��Ŀ����
����Ŀ��ijѧ������Ԫ��������ԭ�ӽṹ��ϵ��ʵ��ʱ�������һ��ʵ�鷽��������¼���йص�ʵ�������������ѧ�����������ʵ�鱨�档
(1)ʵ��Ŀ��
̽��ͬһ����Ԫ�����ʵĵݱ����
(2)ʵ����Ʒ
�������Թܡ���ͷ�ι�
ҩƷ��������ˮ��������ˮ���廯����Һ���⻯����Һ�����Ȼ�̼
(3)ʵ������(���±���������д�������)___________��__________
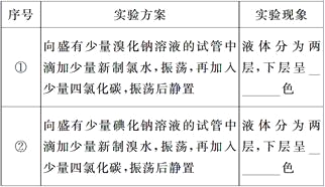
(4)ʵ����ۣ�______________________________________________________________��
(5)���������
����������ʵ���з�����Ӧ�����ӷ���ʽ�ֱ�Ϊ____________________________��________________________________________________________________________��
�����ڷ����ʹ��ڻ��ã����Ժ�����Ƴ�һ����ʵ������֤�������Ե�ǿ�������о�������ʵ˵�����ķǽ����Ա��ȵ�ǿ________________��__________________________��
���𰸡� �Ⱥ� �Ϻ� ͬ����Ԫ�ش��ϵ��£�Ԫ��ԭ�ӵĵõ����������� Cl2��2Br��===Br2��2Cl�� 2I����Br2===2Br����I2 ��������ȶ��Ա��Ȼ����ǿ �������û���ˮ�е����������������û���ˮ�е���
��������(3)��������������,�ܽ�����������Ϊ�嵥��,�嵥�����л�����ʾ�Ⱥ�ɫ���嵥���ܽ�����������Ϊ�ⵥ�����ⵥ�����л�������ʾ�Ϻ�ɫ��
(4)����ʵ����������������������ǿ��������������������ó�ͬ����Ԫ�����ʵĵݱ������
(5)����������������,�ܽ�����������Ϊ�嵥��,�嵥���ܽ�����������Ϊ�ⵥ����
�����ݵ��ʺ��������ϵõ����⻯����ȶ��ԡ�����֮����û���Ӧ���Եó�Ԫ�صķǽ�����ǿ��˳����
��3����������������,�ܽ�����������Ϊ�嵥��,�嵥�ʸ����������Ȼ�̼��,���л�����ʾ�Ⱥ�ɫ���嵥���ܽ�����������Ϊ�ⵥ��,�ⵥ�ʸ����������Ȼ�̼��,���л�������ʾ�Ϻ�ɫ����ȷ��:�Ⱥ����Ϻ���
(4)��������������,�ܽ�����������Ϊ�嵥��,����������������ǿ���嵥��,�嵥���ܽ�����������Ϊ�ⵥ��,�������������嵥��ǿ�ڵⵥ��,������Խǿ,Ԫ�صķǽ�����Խǿ,���ǽ�����:Cl>Br>I,�ó�ͬ����Ԫ�����ʵĵݱ����:ͬ����Ԫ����������,�Ҵ��ϵ���,Ԫ�صķǽ�������������ȷ����ͬһ����,���϶���,Ԫ�صķǽ��������μ�����
(5)����������������,�ܽ�����������Ϊ�嵥��, Cl2��2Br��===Br2��2Cl�����嵥���ܽ�����������Ϊ�ⵥ��2I����Br2===2Br����I2����ȷ��: Cl2��2Br��===Br2��2Cl����2I����Br2===2Br����I2��
��)�����������ֱ���������ϵõ����⻯����ȶ���:HF>HCl���⻯��Խ�ȶ����ǽ�����Խǿ������F�ķǽ����Ա�Clǿ��F2���û���ˮ�е���,��Cl2�����û���ˮ�е���,����F�ķǽ����Ա�Clǿ����ȷ������������ȶ��Ա��Ȼ����ǿ���������û���ˮ�е����������������û���ˮ�е�����