��Ŀ����
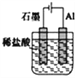
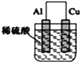
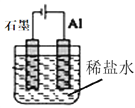
����Ŀ��FePO4��һ��������ˮ������������Ĺ��壬������������������ʵ��������FeSO4.7H2O��H3PO4��(��һ�����볣��Ka1=7.5��l0-3)�Ʊ�FePO4�������£�

(1)���ܽ⡱ʱH3PO4���˹���̫���ԭ����___��
(2)��д������Ӧ��ʱ�ܷ�Ӧ�����ӷ���ʽ��____��
��֤������Ӧ������Ԫ�س�����ȫ��ʵ�鷽����___��
(3)�١����ˡ����ò�Ʒ���ػ�ɫ����FePO4���ܻ��е�������____��
��ϴ��FePO4�����IJ����� ___��
(4)FeSO4��(NH4)2SO4��Ӧ���Ƶ�Ħ����[(NH4)2Fe (SO4)2��6H2O]��Ħ����������ˮ���������Ҵ������ʱ�һ���������ȶ����ӽ�l00��ʱ��ʧȥ�ᾧˮ��������ʵ��ܽ��������ͼ��ʾ��
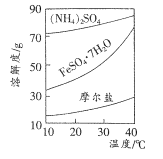
�벹�������ɾ����ڿ����е�FeSO4.7H2O��Ʒ�ϳ�Ħ���ε�.ʵ�鲽�裺����Ʒ����������������Һ�У�����ʹ���ܽ⣬Ȼ�������м���____����ѡ�Լ�������ˮ�������������Һ�� 3% H2O2��ͭ�ۡ����ۡ���ˮ�Ҵ���
���𰸡� ��ֹ������Ӧ�м������NaOH,�˷�ԭ�� 2Fe2++ClO-+2H3PO4+4OH-=2FePO4��+Cl-+5H2O ȡ������Һ���Թ��У���������ˮ���ٵμ�KSCN��Һ������Һ����죬˵����Ԫ�س�����ȫ�� Fe(OH)3 ��������м�������ˮ��û����������ˮ�������ظ����������������� �������ۣ����ȹ��ˣ�����Һ�м���������ı����������Һ���Ũ������ȴ�ᾧ�����ˣ�����ˮ�Ҵ�ϴ�ӡ�����100����
��������(1) ��ֹ������Ӧ�м������NaOH,�˷�ԭ�ϣ��ʡ��ܽ⡱ʱH3PO4���˹���̫�ࣻ(2)�١���Ӧ��ʱ�������ӱ�����������������������������������������Ӳ����������������ܷ�Ӧ�����ӷ���ʽ��2Fe2++ClO-+2H3PO4+4OH-=2FePO4��+Cl-+5H2O����֤������Ӧ������Ԫ�س�����ȫ����Ӧ�ü�����Һ�в������������Ӻ������ӣ�ʵ�鷽����ȡ������Һ���Թ��У���������ˮ���ٵμ�KSCN��Һ������Һ����죬˵����Ԫ�س�����ȫ��(3)�١����ˡ����ò�Ʒ���ػ�ɫ����FePO4���ܻ��е�������Fe(OH)3����ϴ��FePO4�����IJ�������������м�������ˮ��û����������ˮ�������ظ�������������������(4)ʵ�鲽�裺����Ʒ����������������Һ�У�����ʹ���ܽ⣬Ȼ�������м����������ۣ����ȹ��ˣ�����Һ�м���������ı����������Һ���Ũ������ȴ�ᾧ�����ˣ�����ˮ�Ҵ�ϴ�ӡ�����100���ɡ���ѡ�Լ�������ˮ�������������Һ�� 3% H2O2��ͭ�ۡ����ۡ���ˮ�Ҵ���

����Ŀ������������գ�
��1��̼������Һ�и����Ӱ���Ũ�ȴӴ�С��˳������Ϊ�� ��
��2���±��Ǽ��ֳ�������ĵ���ƽ�ⳣ����25�棩
�� | H2CO3 | CH3COOH | HClO |
K | K1=4.4��10��7��K 2=4.7��10��11 | K=1.76��10��5 | K=2.95��10��8 |
���ݷ������������ݿ�֪��H2CO3��CH3COOH��HClO ����������Դ�ǿ������������25��ʱ����Ũ�ȵ�Na2CO3��NaAc ��NaClO������Һ��pH��С���������� ��
��3�������£���0.02molL��1 �� Ba��OH��2��Һ100mL��0.02molL��1��NaHSO4��Һ100mL��ϣ���������Һ����仯�����Ϻ����Һ�� pH Ϊ ��
��4��25��ʱ��Ksp[Mg��OH��2]=5.61��10��12 �� Ksp[MgF2]=7.42��10��11 �� ���¶��±���Mg��OH��2��Һ�뱥�� MgF2��Һ��ȣ����ѧʽ����Һ�е� c��Mg2+����