题目内容
16.下列解释实验事实的方程式正确的是( )| A. | CuSO4溶液中加入过量氨水得到深蓝色溶液:Cu2++2OH-═Cu(OH)2↓ | |
| B. | 碳酸钠溶液中滴入酚酞试液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | FeCl2溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| D. | 90℃时,测得纯水pH=6.7,pH<7的原因是:H2O(l)?H+(aq)+OH-(aq)△H<0 |
分析 A.加入过量氨水,反应生成[Cu(NH3)4]2+;
B.水解分步进行,以第一步为主;
C.生成蓝色沉淀为Fe3[Fe(CN)6]2;
D.升高温度促进水的电离.
解答 解:A.CuSO4溶液中加入过量氨水得到深蓝色溶液的离子反应为Cu2++4NH3.H2O═4H2O+[Cu(NH3)4]2+,故A错误;
B.碳酸钠溶液中滴入酚酞试液,溶液变红的离子反应为CO32-+H2O?HCO3-+OH-,故B错误;
C.FeCl2溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀的离子反应为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,故C正确;
D.90℃时,测得纯水pH=6.7,pH<7的原因是:H2O(l)?H+(aq)+OH-(aq)△H>0,故D错误;
故选C.
点评 本题考查离子反应的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、水解反应的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
7.在研究有机历程时,常用816O作为示踪原子.816O的原子核内中子数是( )
| A. | 8 | B. | 18 | C. | 10 | D. | 28 |
4.W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中 的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体.已知反应:甲+乙→丁+己,甲+丙→戊+己.又知常温下0.01mol•L-1丁溶液的pH为12.下列说法正确的是( )
| A. | 元素X在周期表中的位置为第2周期VIA族 | |
| B. | 1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 | |
| C. | 元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(x) | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子的总物质的量小于0.1 mol |
11.下列有关溶液的说法正确的是( )
| A. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl 溶液、④(NH4)2Fe(SO4)2溶液中,c(${NH}_{4}^{+}$)的大小关系:④>①>②>③ | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(${HCO}_{3}^{-}$)+c(${CO}_{3}^{2-}$) |
1. 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2- | |
| B. | 若Y是盐酸,则溶液中可能含有的阳离子是Al3+ | |
| C. | 若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl- |
5.下列有关叙述中不正确的是( )
| A. | 酯存在于许多水果鲜花中具有特殊的香味 | |
| B. | 乙酸和甲醇在一定条件下也能发生酯化反应 | |
| C. | 酯化反应也属于取代反应 | |
| D. | 酯化反应中需要稀硫酸做催化剂 |

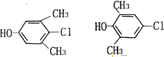 (写两种)
(写两种) 的化学方程式
的化学方程式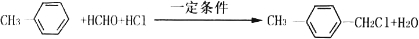 ,
, CH3COOCH3+H2O.
CH3COOCH3+H2O.