题目内容
6.碘是人类必须的生命元素,在人体生长发育过程中起着重要作用.Ⅰ.海带或海苔中含有丰富的碘元素,是人体碘的一种来源.下图是实验室从海带(含I-)中提取碘单质的流程图.
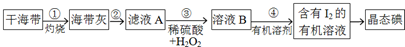
(1)步骤①中灼烧海带用到的实验仪器是a(填序号).
a.坩埚 b.试管 c.蒸发皿 d.烧杯
(2)步骤②的实验操作包括溶解、过滤.步骤④中分液所用的玻璃仪器是分液漏斗、烧杯.
(3)步骤③中反应的离子方程式是2H++2I-+H2O2=I2+2H2O.
Ⅱ.人体碘的重要来源之一是食用加碘食盐(含KIO3).为测定加碘食盐样品的碘含量,某实验小组设计了如下实验:
①用天平准确称取w g食盐样品,加适量蒸馏水使其完全溶解.
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全生成I2.
③以淀粉为指示剂,逐滴加入浓度为2.0×10-3 mol•L-1的Na2S2O3溶液6.00 mL,恰好反应完全.(已知:I2+2S2O32-═2I-+S4O62-)
(1)配平步骤②中反应的离子方程式:1IO3-+5I-+6H+═3I2+3H2O
(2)步骤③中判断反应恰好完全的现象是蓝色褪去.
(3)上述实验样品中碘元素的含量是$\frac{254}{w}$mg/kg(以含w的代数式表达).
分析 I.(1)灼烧固体用坩埚;
(2)海带灰加水溶解、过滤,滤液为含有碘离子的溶液;分液时用到分液漏斗和烧杯;
(3)酸性条件下,碘离子被双氧水氧化物单质碘;
II.(1)反应中IO3-得到5个电子,I-失去1个电子,根据得失电子守恒和原子守恒配平方程式;
(2)以淀粉为指示剂,溶液显蓝色,达到终点时,单质碘完全反应,溶液蓝色褪去;
(3)已知IO3-+5I-+6H+=3I2+3H2O,I2+2S2O32-═2I-+S4O62-,则IO3-~3I2~6S2O32-,根据关系式计算IO3-的物质的量,再计算碘元素的含量.
解答 解:I.(1)步骤①中灼烧海带用到的实验仪器是坩埚;
故答案为:坩埚;
(2)海带灰加水溶解、过滤,滤液为含有碘离子的溶液,则步骤②的实验操作包括溶解、过滤;碘离子的溶液,加有机溶剂萃取后,溶液分层,然后用分液漏斗分液,用烧杯盛放分离的液体;
故答案为:溶解、过滤;分液漏斗、烧杯;
(3)酸性条件下,碘离子被双氧水氧化物单质碘,其反应的离子方程式为:2H++2I-+H2O2=I2+2H2O;
故答案为:2H++2I-+H2O2=I2+2H2O;
II.(1)反应中IO3-得到5个电子,I-失去1个电子,根据得失电子守恒可知IO3-的计量数为1,I-的计量数为5,利用原子守恒配平方程式为IO3-+5I-+6H+=3I2+3H2O;
故答案为:1、5、6、3、3;
(2)碘遇淀粉试液变蓝色,如果溶液中不存在碘单质,达到终点时,单质碘完全反应,溶液蓝色褪去,
故答案为:蓝色褪去;
(3)已知IO3-+5I-+6H+=3I2+3H2O,I2+2S2O32-═2I-+S4O62-,
则IO3-~3I2~6S2O32-,
则n(IO3-)=6n(S2O32-)=6×2.0×10-3 mol•L-1×0.006L,
所以m(I)=6×2.0×10-3 mol•L-1×0.006L×127g/mol=0.254mg,
每wg食盐中含有0.254mg碘,
设每1Kg食盐中含有碘xmg,
则$\frac{xmg}{1000g}$=$\frac{0.254mg}{wg}$,解得x=$\frac{254}{w}$mg
故答案为:$\frac{254}{w}$.
点评 本题考查了物质的分离提纯、氧化还原反应、碘的检测等知识点,难点是计算食盐中碘含量,明确碘酸钾和硫代硫酸钠的关系式是解本题关键,难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案| A. | 乙酸与乙酸乙酯的混合物,可通过蒸馏或用足量饱和碳酸钠溶液洗涤后分液的方法进行分离 | |
| B. | 做金属钠和水反应实验时,切割下来的表层物质,也不能直接丢弃到废纸篓里,而应放回原试剂瓶 | |
| C. | 酸式滴定管在润洗时,可在滴定管中加入少量待装液,润洗后将溶液从滴定管的上口倒入废液缸中,重复2~3次,润洗完毕 | |
| D. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
| A. | 氨常用作制冷剂,是因为其沸点较高,很容易液化 | |
| B. | 常温下氨水与铁不反应,因此氨水可盛放在铁桶里 | |
| C. | 用热的纯碱溶液洗去油污,是因为纯碱可以增强油污的挥发性 | |
| D. | 氯气具有强氧化性,因此可漂白有色布料 |
 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2- | |
| B. | 若Y是盐酸,则溶液中可能含有的阳离子是Al3+ | |
| C. | 若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl- |
| A. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 | |
| B. | 必须的定量仪器有100mL量筒、250mL容量瓶和托盘天平 | |
| C. | 量取质量分数为98%的浓硫酸(ρ=1.84g•cm-3)的体积为25.0mL | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容器瓶加入定容 |
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
 L B.
L B. L C.
L C. L D.
L D. L
L