题目内容
13.向3支盛有少量Mg(OH)2沉淀的试管中分别滴加适量的蒸馏水,盐酸和氯化铵溶液,观察并记录现象,并写出实验中有关反应的化学方程式.| 滴加试剂 | 蒸馏水 | 盐酸 | 氯化铵溶液 |
| 现象 |
分析 Mg(OH)2饱和溶液中存在沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),据此解答即可.
解答 解:Mg(OH)2饱和溶液中存在沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入适量的水,可以促进部分氢氧化镁沉淀溶解,但是现象不明显;
盐酸电离出大量的氢离子,氢离子结合氢氧化镁电离出的氢氧根离子形成水,促进了氢氧化镁的溶解,最终沉淀消失,化学反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;NH4Cl水解使溶液呈酸性,促进氢氧化镁溶解,最终白色沉淀消失,且有气体放出,化学反应方程式为:Mg(OH)2+2NH4Cl=MgCl2+NH3↑+H2O,故答案为:无现象;白色沉淀消失,Mg(OH)2+2HCl=MgCl2+2H2O;白色沉淀消失,有气体放出,Mg(OH)2+2NH4Cl=MgCl2+NH3↑+H2O.
点评 本题主要考查的是氢氧化镁的沉淀溶解平衡以及影响其溶解平衡的因素,注意从平衡的角度分析即可,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
3.现有三组混合物:①水和苯 ②汽油和柴油 ③碘和氯化钠单质溶液,正确的分离方法依次是( )
| A. | 萃取,蒸馏,分液 | B. | 分液,萃取,蒸馏 | C. | 蒸馏,萃取,分液 | D. | 分液,蒸馏,萃取 |
4.W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中 的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体.已知反应:甲+乙→丁+己,甲+丙→戊+己.又知常温下0.01mol•L-1丁溶液的pH为12.下列说法正确的是( )
| A. | 元素X在周期表中的位置为第2周期VIA族 | |
| B. | 1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 | |
| C. | 元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(x) | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子的总物质的量小于0.1 mol |
1. 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2- | |
| B. | 若Y是盐酸,则溶液中可能含有的阳离子是Al3+ | |
| C. | 若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl- |
18.配置240mL1.84mol•L-1稀硫酸,下列操作正确的是( )
| A. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 | |
| B. | 必须的定量仪器有100mL量筒、250mL容量瓶和托盘天平 | |
| C. | 量取质量分数为98%的浓硫酸(ρ=1.84g•cm-3)的体积为25.0mL | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容器瓶加入定容 |
5.下列有关叙述中不正确的是( )
| A. | 酯存在于许多水果鲜花中具有特殊的香味 | |
| B. | 乙酸和甲醇在一定条件下也能发生酯化反应 | |
| C. | 酯化反应也属于取代反应 | |
| D. | 酯化反应中需要稀硫酸做催化剂 |
2.有机物经核磁共振检测,给出3种信号的有( )
| A. | CH3OH | B. | CH3CH2CH3 | ||
| C. | 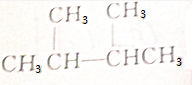 | D. | CH3COOCH2CH3 |
2.下列关于催化剂的说法错误的是( )
| A. | 温度越高,催化剂的催化效果越好 | |
| B. | 汽车排气管上的“催化转化器”能减少有害气体排放 | |
| C. | 催化剂可以改变化学反应速率,但不能破坏化学平衡 | |
| D. | 催化剂可以改变化学反应路径,且反应前后其质量和化学性质都不发生变化 |
 CH3COOCH3+H2O.
CH3COOCH3+H2O.