题目内容
7.下列有关化学实验的叙述中,正确的是( )| A. | 用碱式滴定管量取20mL0.1000mol/LKMnO4溶液 | |
| B. | 只用浓氨水就可以鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用四氯化碳萃取溴水中的溴并分液,有机层应从分液漏斗的上口倒出 | |
| D. | 测定中和反应的反应热时,将碱缓缓倒入酸中,测出的温度变化值偏小 |
分析 A.高锰酸钾能氧化橡胶;
B.加入浓氨水溶液,NaCl、Na2SO4无现象;
C.四氯化碳密度比水大,应从分液漏斗的下端流出;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大.
解答 解:A.高锰酸钾能氧化橡胶,应用酸式滴定管量取KMnO4溶液,故A错误;
B.加入浓氨水溶液,NaCl、Na2SO4无现象,AlCl3与氨水反应生成白色沉淀,且沉淀不溶解,MgCl2生成白色沉淀,不可鉴别,故B错误;
C.四氯化碳密度比水大,位于液体下层,则应从分液漏斗的下端流出,故C错误;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度值偏小,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的分离、提纯以及检验等,为高频考点,侧重于学生的分析能力和实验能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
18.臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)?N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列有关说法正确的是( )
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
15.下列有关化学用语表示正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}Cl$ | B. | 四氯化碳的电子式: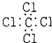 | ||
| C. | 铝原子的结构示意图: | D. | 二氧化碳的结构式:O-C-O |
12.下列实验能达到预期目的是( )
| A. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 | |
| B. | 向淀粉溶液中加入稀H2SO4,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解 | |
| C. | 将蔗糖和稀H2SO4加热水解后的液体取出少许,加入新制的Cu(OH)2并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖 | |
| D. | 蛋白质溶液中加入丙酮可以使蛋白质从溶液中析出,再加水又能溶解 |
19.在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 单位时间内生成0.5molA的同时,消耗1molC | |
| D. | V(C正):V(D正)=2:1 |
16.下列说法中正确的是( )
| A. | 主族元素的原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8 | |
| D. | 互为同位素的元素物理性质、化学性质均相同 |
17.下列物质中,既含离子键、又含共价键的是( )
| A. | NaOH | B. | Na2O | C. | H2O | D. | CaCl2 |