题目内容
19.在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 单位时间内生成0.5molA的同时,消耗1molC | |
| D. | V(C正):V(D正)=2:1 |
分析 可逆反应达到平衡状态时,正逆反应速率相等且不等于0,各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.该反应的反应前后气体的物质的量之和不变,则无论该反应是否达到平衡状态,压强始终不变,所以压强不能作为判断依据,故A错误;
B.该反应前后气体的物质的量不变,但气体质量改变,所以其密度在反应前后改变,当密度不变时正逆反应速率相等,所以能作为判断平衡状态的依据,故B正确;
C.无论该反应是否达到平衡状态,单位时间内生成0.5molA的同时消耗1molC,所以不能据此判断平衡状态,故C错误;
D.无论该反应是否达到平衡状态始终存在V(c正):V(D正)=2:1,所以不能据此判断平衡状态,故D错误;
故选B.
点评 本题考查化学平衡状态的判断,正确选择平衡状态依据是解本题关键,只有反应前后改变的物理量才能作为判断依据,注意该反应特点,题目难度不大.

练习册系列答案
相关题目
10.若某基态原子的外围电子排布为4d15s2,则下列说法错误的是( )
| A. | 该元素位于第5周期,ⅢB族 | B. | 该元素原子核外有5个电子层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M能层共有8个电子 |
7.下列有关化学实验的叙述中,正确的是( )
| A. | 用碱式滴定管量取20mL0.1000mol/LKMnO4溶液 | |
| B. | 只用浓氨水就可以鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用四氯化碳萃取溴水中的溴并分液,有机层应从分液漏斗的上口倒出 | |
| D. | 测定中和反应的反应热时,将碱缓缓倒入酸中,测出的温度变化值偏小 |
14.下列各组离子在强碱性溶液里能大量共存的是( )
| A. | Na+、K+、Mg2+、SO42- | B. | Ba2+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、S2-、CO32- | D. | Na+、S2- ClO-、Cl- |
11.关于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O下列说法错误的是( )
| A. | 每生成1mol单质硫,转移电子总数为2NA | |
| B. | 升高温度,生成硫沉淀的速率加快,说明升高温度可加快化学反应速率 | |
| C. | 增大压强对该反应的速率几乎没有影响 | |
| D. | 由于反应产生SO2气体,所以可以通过观察生成气泡的快慢比较稀、浓硫酸与Na2S2O3反应的速率大小 |
8.下列过程中,不可逆的是( )
| A. | 蛋白质的盐析 | B. | 乙酸的电离 | ||
| C. | 酯在酸的催化下的水解 | D. | 蛋白质的变性 |
9.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )
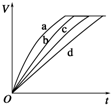
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 50 | 粉末状 |

| A. | 1-2-4-3 | B. | 1-2-3-4 | C. | 3-4-2-1 | D. | 4-3-2-1 |
 C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.
C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.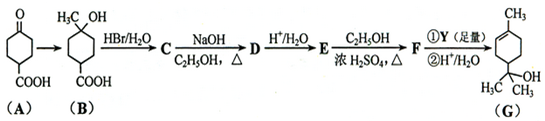
 .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.