题目内容
17.下列物质中,既含离子键、又含共价键的是( )| A. | NaOH | B. | Na2O | C. | H2O | D. | CaCl2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属族元素、碱土金属元素和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故A正确;
B.氧化钠中钠离子和氧离子之间存在离子键,故B错误;
C.水分子中H-O原子之间只存在共价键,故C错误;
D.氯化钙中钙离子和氯离子之间只存在离子键,故D错误;
故选A.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确二者区别即可解答,注意氯化钙中两个氯离子之间不存在化学键,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列有关化学实验的叙述中,正确的是( )
| A. | 用碱式滴定管量取20mL0.1000mol/LKMnO4溶液 | |
| B. | 只用浓氨水就可以鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用四氯化碳萃取溴水中的溴并分液,有机层应从分液漏斗的上口倒出 | |
| D. | 测定中和反应的反应热时,将碱缓缓倒入酸中,测出的温度变化值偏小 |
8.下列过程中,不可逆的是( )
| A. | 蛋白质的盐析 | B. | 乙酸的电离 | ||
| C. | 酯在酸的催化下的水解 | D. | 蛋白质的变性 |
5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Cu2+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Na +、HCO3-、SO42- | D. | Na+、NH4+、Br-、OH- |
12.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | H3O+、NH4+、Cl- | C. | HF、Ne、H2O | D. | NH3、NH4+、F- |
2.下列叙述正确的是( )
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | NCl3的电子式为 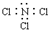 | ||
| C. | 甲酸乙酯的结构简式:C2H5OOCH | D. | 次氯酸的结构式H-Cl-O |
9.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )
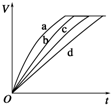
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 50 | 粉末状 |

| A. | 1-2-4-3 | B. | 1-2-3-4 | C. | 3-4-2-1 | D. | 4-3-2-1 |
7.用下列装置制取并收集NO2气体,其中最合理的是( )
| A. | 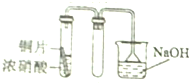 | B. | 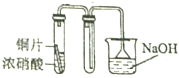 | ||
| C. |  | D. |  |