题目内容
15.下列有关化学用语表示正确的是( )| A. | 中子数为20的氯原子:${\;}_{17}^{20}Cl$ | B. | 四氯化碳的电子式: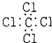 | ||
| C. | 铝原子的结构示意图: | D. | 二氧化碳的结构式:O-C-O |
分析 A、中子数为20,则质量数为37,元素符号左上角的数字为质量数;
B、CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合;
C、Al原子序数为13,有3个电子层,最外层3个电子;
D、二氧化碳中C分别与O形成2对共价键,据此解答即可.
解答 解:A.元素符号的左上角标质量数,中子数为20的氯原子,质量数=质子数+中子数=20+17=37,故该符号为1737Cl,故A错误;
B、CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4电子式为 ,故B错误;
,故B错误;
C、Al原子序数为13,有3个电子层,最外层3个电子,原子结构示意图为: ,故C正确;
,故C正确;
D、二氧化碳中C分别与O形成2对共价键,结构式为O=C=O,故D错误,故选C.
点评 本题主要考查的是核素中各部分的含义、共价化合物电子式的书写、原子结构示意图书写.结构式等,综合性较强,但是难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
3.某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中舍有Ni70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化台物的化学性质与铁的类似,但Ni2-的性质较稳定).

已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
(1)滤渣a的成分是SiO2,用乙醇洗涤废催化剂的目的是溶解、除去有机物,从废渣中回收乙醇的方法是蒸馏.
(2)为提高酸浸速率,可采取的措施有(答两条)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度.
(3)向A中加人 H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.试剂x可以是NaOH.
(4)用方程式表示出由沉淀.制取单质镍的方法Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni.
回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为(70%×97%m+$\frac{59}{93}$a)×95%kg(填计算式).
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应.2Ni2++1H2PO2-+H2O=2Ni++1H2PO3-+2H+
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源.

已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(2)为提高酸浸速率,可采取的措施有(答两条)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度.
(3)向A中加人 H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.试剂x可以是NaOH.
(4)用方程式表示出由沉淀.制取单质镍的方法Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni.
回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为(70%×97%m+$\frac{59}{93}$a)×95%kg(填计算式).
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应.2Ni2++1H2PO2-+H2O=2Ni++1H2PO3-+2H+
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源.
10.若某基态原子的外围电子排布为4d15s2,则下列说法错误的是( )
| A. | 该元素位于第5周期,ⅢB族 | B. | 该元素原子核外有5个电子层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M能层共有8个电子 |
7.下列有关化学实验的叙述中,正确的是( )
| A. | 用碱式滴定管量取20mL0.1000mol/LKMnO4溶液 | |
| B. | 只用浓氨水就可以鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用四氯化碳萃取溴水中的溴并分液,有机层应从分液漏斗的上口倒出 | |
| D. | 测定中和反应的反应热时,将碱缓缓倒入酸中,测出的温度变化值偏小 |
5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Cu2+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Na +、HCO3-、SO42- | D. | Na+、NH4+、Br-、OH- |
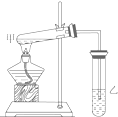 如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作: ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.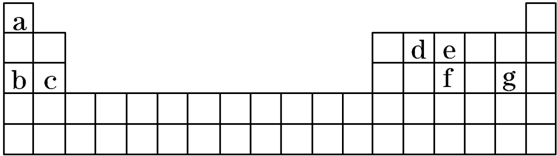
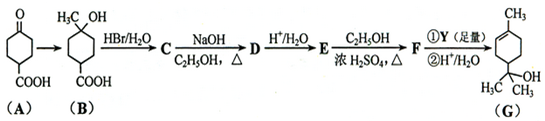
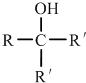
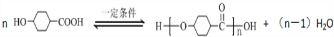
 .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.