题目内容
16.下列说法中正确的是( )| A. | 主族元素的原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8 | |
| D. | 互为同位素的元素物理性质、化学性质均相同 |
分析 A、根据钾离子或钠离子等微粒的核外电子层数以及该元素所在的周期数来回答;
B、根据元素周期表中过渡元素的分布来回答;
C、根据稀有气体原子的核外电子排布特点来回答;
D、根据同位素的概念:具有相同质子数和不同中子数的同一元素的不同原子之间的互称来回答.
解答 解:A、钾离子的核外电子层数为3,该元素所在的周期数为4;钠离子的核外电子层数为2,该元素所在的周期数为3,均不相等,故A错误;
B、元素周期表中从IIIB族到IIB族10个纵行的元素都是过渡元素,过渡元素全部为金属元素,故B正确;
C、稀有气体原子中,只有氦原子的最外层电子数为2,其余的均为8,故C错误;
D、同一元素的各种同位素的物理性质不同,各种同位素的质子数相同,质子数决定化学性质,故化学性质相同,故D错误.
故选B.
点评 本题是对基本概念知识的考查,学生可以根据所学知识解答,明确元素周期表的结构及元素在周期表中的位置即可解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列有关化学实验的叙述中,正确的是( )
| A. | 用碱式滴定管量取20mL0.1000mol/LKMnO4溶液 | |
| B. | 只用浓氨水就可以鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用四氯化碳萃取溴水中的溴并分液,有机层应从分液漏斗的上口倒出 | |
| D. | 测定中和反应的反应热时,将碱缓缓倒入酸中,测出的温度变化值偏小 |
11.关于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O下列说法错误的是( )
| A. | 每生成1mol单质硫,转移电子总数为2NA | |
| B. | 升高温度,生成硫沉淀的速率加快,说明升高温度可加快化学反应速率 | |
| C. | 增大压强对该反应的速率几乎没有影响 | |
| D. | 由于反应产生SO2气体,所以可以通过观察生成气泡的快慢比较稀、浓硫酸与Na2S2O3反应的速率大小 |
1.下列物质的电子式书写正确的是( )
①Ca(OH)2
 ②H2S
②H2S 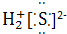
③OH-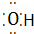 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
⑥CO2 ⑦HClO
⑦HClO 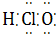 ⑧Na2O2
⑧Na2O2 
①Ca(OH)2

 ②H2S
②H2S 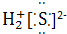
③OH-
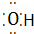 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N⑥CO2
 ⑦HClO
⑦HClO 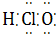 ⑧Na2O2
⑧Na2O2 
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
8.下列过程中,不可逆的是( )
| A. | 蛋白质的盐析 | B. | 乙酸的电离 | ||
| C. | 酯在酸的催化下的水解 | D. | 蛋白质的变性 |
5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Cu2+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Na +、HCO3-、SO42- | D. | Na+、NH4+、Br-、OH- |
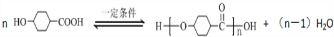
 .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.