题目内容
4.①MgCl2 ②干冰 ③冰 ④Na2O2⑤白磷(P4) ⑥硫磺⑦Na2CO3 ⑧金刚石 ⑨NaOH ⑩SiO2(1)以上物质中属于离子晶体的是①④⑦⑨;
(2)属于分子晶体的是②③⑤⑥.
(3)属于原子晶体的是⑧⑩(填序号)
分析 微粒间以分子间作用力结合形成的晶体为分子晶体,大多数共价化合物和非金属单质为分子晶体;微粒间以共价键结合形成空间网状结构的晶体为原子晶体,硅、二氧化硅、碳化硅、金刚石等属于原子晶体;阴阳离子之间通过离子键形成的晶体为离子晶体,活泼金属和活泼非金属形成的化合物一般为离子晶体,铵盐也属于离子晶体.
解答 解:①MgCl2 ④Na2O2 ⑦Na2CO3⑨NaOH 这四种物质是由阴阳离子构成的,属离子晶体;
②干冰 ③冰 ⑤白磷(P4)⑥硫磺 这四种物质是由分子构成的,属分子晶体,
⑧金刚石 ⑩SiO2 这两种物质是由原子构成的,属原子晶体;
故答案为:(1)①④⑦⑨;(2)②③⑤⑥;(3)⑧⑩.
点评 本题考查了晶体类型的判断,题目难度不大,注意把握不同类型晶体的构成微粒.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
14.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙醇(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
19.25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布图如下,下列结论正确的是( )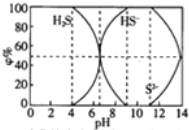

| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
9.有下列七种物质:①甲烷、②苯、③聚乙烯、④聚乙炔、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ②③④⑤ | B. | ③④⑤⑦ | C. | ④⑤⑥ | D. | ④⑤⑦ |
16.已知短周期元素的离子,A2+,B+,C3-,D- 都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 离子半径C>D>B>A | B. | 原子序数D>C>B>A | ||
| C. | 原子半径A>B>D>C | D. | 单质的还原性A>B>D>C |
一定条件下,通过下列反应可以制备特种陶瓷的原料M gO: MgSO4(s)+ CO(g)  MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
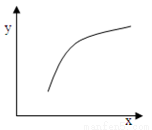
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
11.某化合物由C、H两种元素组成,其中含碳的质量分数85.7%,在标准状况下,11.2L此化合物气体的质量为14g.则此化合物的分子式为( )
| A. | C2H4 | B. | C3H6 | C. | C6H6 | D. | CH4 |
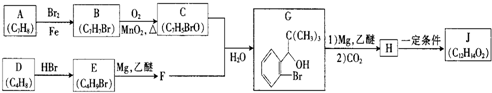
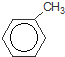 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$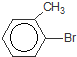 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应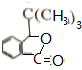
 .
.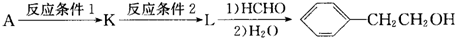
 .
.