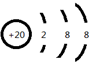题目内容
11.某化合物由C、H两种元素组成,其中含碳的质量分数85.7%,在标准状况下,11.2L此化合物气体的质量为14g.则此化合物的分子式为( )| A. | C2H4 | B. | C3H6 | C. | C6H6 | D. | CH4 |
分析 根据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,再结合M=$\frac{m}{n}$计算气体摩尔质量,根据元素质量分数计算分子中C、H原子数目,进而确定分子式.
解答 解:标况下,11.2L气体烃的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,
该气态烃的摩尔质量=$\frac{14g}{0.5mol}$=28g/mol,
烃分子中C原子数目=$\frac{28×85.7%}{12}$=2,H原子数目=$\frac{28-12×2}{1}$=4,
故烃的分子式为C2H4,
故选A.
点评 本题考查有机物分子式的确定,比较基础,注意掌握用相对分子质量确定烃的分子式方法.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
2.在空气中放置一段时间的KOH经分析知其中含水a%,含K2CO3b%,其余为KOH.取此样品mg溶于100mL浓度为1mol/L的H2SO4中,所得溶液中剩余的H2SO4需加ngKOH才能完全中和,然后将溶液蒸干,可得固体物质(不含结晶水)的质量为( )
| A. | 3.1(m+n)g | B. | 14.2g | C. | 17.4g | D. | 20.6g |
19.下列化学式中,具有非极性键的离子化合物是( )
| A. | H2O2 | B. | MgF2 | C. | NaOH | D. | Na2O2 |
16.下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ②⑤⑦ | B. | ②④⑥ | C. | ②④⑤⑥⑦ | D. | ②⑥⑦ |
18.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
| A. | H2S+2HNO3═S↓+2NO2↑十2H2O | B. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑十O2↑十2H2O | ||
| C. | 3FeO+10HNO3═3Fe(NO3)3十5H2O+NO↑ | D. | CuO+2HNO3═3Cu(NO3)2+H2O |
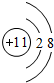
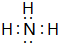 ,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.
,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.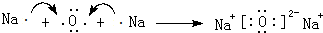 .
.
 ,⑥与⑨形成的5原子分子的结构式为
,⑥与⑨形成的5原子分子的结构式为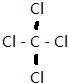 .
.