题目内容
19.25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布图如下,下列结论正确的是( )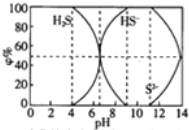
| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
分析 A、当c(HS-)>c(S2-)时,图象分析可知溶液中只存在NaHS、Na2S,12>pH>6.5时,c(HS-)>c(S2-),溶液可以显酸性或碱性;
B、当pH=7时溶液呈中性,c(H+)=c(OH-),硫元素存在微粒为HS-和H2S,依据溶液中电荷守恒:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-)计算;
C、12>pH>4,溶液中存在微粒HS-,H2S,滴加0.1mol/L CuSO4溶液,依据图象和Ksp分析可知两种情况下都生成沉淀;
D、当pH=9时,溶液全部是NaHS,依据溶液中质子守恒和电荷守恒计算分析.
解答 解:A、当c(HS-)>c(S2-)时,图象分析可知溶液中只存在NaHS、Na2S,S2-+H2O?HS-+OH-,12>PH>6.5时,c(HS-)>c(S2-),溶液可以显酸性或碱性,故A错误;
B、当pH=7时溶液呈中性,c(H+)=c(OH-),硫元素存在微粒为HS-和H2S,依据溶液中电荷守恒:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-),计算得到c(Na+)=c(HS-)+2c(S2-),故B错误;
C、12>PH>4,溶液中存在微粒HS-,H2S,滴加0.1mol/L CuSO4溶液,设溶液体积1L,HS-为x,H2S浓度0.1-x,HS-+Cu2+=CuS↓+2H+,H2S+Cu2+=CuS↓+2H+,x<0.1mol/L,铜离子过量,溶液中过量的铜离子浓度为c(Cu2+)=(0.1-x)mol/L,依据Ksp计算溶液中c(S2-)=$\frac{6.3×1{0}^{-36}}{0.1-x}$<10-5mol/L,所以溶液硫离子全部沉淀,溶液中一定生成硫化铜沉淀,故C正确;
D、当pH=9时,溶液全部是NaHS,依据溶液中质子守恒得到:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-),物料守恒为:c(Na+)=c(HS-)+c(S2-)+c(H2S),则c(H+)+c(H2S)=c(S2-)+c(OH-),根据图知,c(H2S)=0,所以c(H+)=c(S2-)+c(OH-),故D错误;
故选C.
点评 本题考查了图象分析判断,电解质溶液中离子浓度大小分析应用,物料守恒、电荷守恒、计算分析判断,注意图象的理解应用,掌握基础是关键,题目难度较大.

| A. | 2:3 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
| 物质 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | Kal=4.4×10-7 Ka2=4.7×10-11 | 3.0×10-8 |
mol-1 ②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1.
(2)将浓度为0.1mol•L-1的HF溶液加水稀释一倍(假设温度不变),下列各项中的值将增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(H+)}{c(HF)}$ D.$\frac{c(OH-)}{c(H+)}$
(3)下列方法中,可以使0.10mol•L-1 HF溶液中HF电离程度增大的是d.(请填字母且注意区分大小写,大小写填错不得分)
a.升高温度
b.向溶液中滴入2滴浓盐酸
c.加入少量NaF固体
d.加水稀释.
| A. | 常温常压下,8 g O2与8 g O3均含有4 NA个电子 | |
| B. | 标准状况下,2.24 L SO3的分子数为0.1 NA | |
| C. | 1L 1mol•L-1盐酸中含有NA个HCl分子 | |
| D. | 0.1 mol Fe与足量浓HNO3反应,转移电子数为0.3 NA |
| A. | 一定是甲醛 | B. | 可能是乙醛 | ||
| C. | 混合物中二者的质量比是1:3 | D. | 不可能有此种醛 |

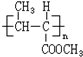 和高聚物H的合成路线如图:
和高聚物H的合成路线如图: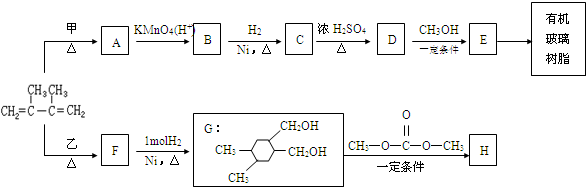
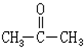 +CH3COOH
+CH3COOH
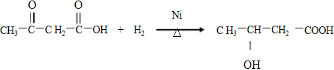 .
. .
.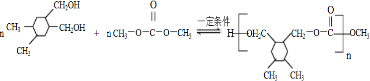 +(2n-1)CH3OH.
+(2n-1)CH3OH.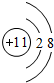
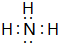 ,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.
,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑. .
.