题目内容
5.Ⅰ.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.【实验1】铜与浓硫酸反应,实验装置如图所示.
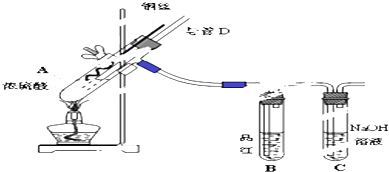
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是试管A中气体压强减小,空气从D导管中进入试管A中.
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D导管口向试管A中通入大量的空气.
Ⅱ.饱和的NaHSO3溶液可以与醛发生加成反应,生成水溶性的α-羟基磺酸钠.发生的反应为:R-CHO+NaHSO3═R-CH(OH)SO3Na反应是可逆的,在通常条件下有70%-90%向正反应方向转化.
(4)利用Ⅰ中装置制取少量NaHSO3溶液,应采取措施,将装置进行部分改变.这种措施是:将B和C的位置对调;确认有NaHSO3生成的现象是品红溶液褪色.
(5)若溴苯中混有杂质乙醛,欲将此杂质除去,可采用的试剂是饱和的NaHSO3溶液,其分离的方法是分液.
(6)若在CH3CH2CH(OH)SO3Na 水溶液中加入足量稀硫酸,有机物转化为CH3CH2CHO,请设计实验检验该有机物:取适量反应后的溶液于干净的试管中,加入过量的氢氧化钠溶液中和过量的硫酸并使溶液呈碱性,向试管中加入1mL新制的Cu(OH)2悬浊液,用酒精灯加热至沸腾,若出现砖红色沉淀,则证明反应后溶液中有CH3CH2CHO.
分析 (1)装置A中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)试管A中气体压强减小,空气从D导管进入试管A中;
(3)从D管口向A中大量鼓气可使装置中残留气体完全被吸收;
(4)过量的二氧化硫与强氧化钠溶液反应生成亚硫酸氢钠,然后用品红溶液检验二氧化硫已经过量,据此进行改变装置;
(5)向利用题中反应将乙醛转化成溶于水的CH3-CH(OH)SO3Na,然后通过分液操作分离即可;
(6)CH3CH2CHO+NaHSO3═CH3CH2CH(OH)SO3Na为可逆反应,加入足量稀硫酸后,亚硫酸氢钠与稀硫酸反应生成硫酸钠、二氧化硫气体和水,平衡向着逆向移动,则反应生成丙醛;可以利用新制的氢氧化铜浊液检验丙醛.
解答 解:(1)装置A中发生反应的化学方程式为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是试管A中气体压强减小,空气从D导管进入试管A中,
故答案为:试管A中气体压强减小,空气从D导管进入试管A中;
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D导管口向试管A中通入大量的空气,
故答案为:从D导管口向试管A中通入大量的空气;
(4)铜与浓硫酸加热生成二氧化硫气体,过量的二氧化硫气体与强氧化钠溶液反应生成NaHSO3,通过品红溶液褪色判断二氧化硫过量,所以利用Ⅰ中装置制取少量NaHSO3溶液,需要将装置B和C位置对调;若品红溶液褪色,则证明二氧化硫是过量的,反应生成了NaHSO3,
故答案为:将B和C的位置对调;品红溶液褪色;
(5)若溴苯中混有杂质乙醛,按题给反应,用饱和NaHSO3与乙醛加成生成可溶于水的CH3-CH(OH)SO3Na,CH3-CH(OH)SO3Na与不溶于水的溴苯分为两层,然后用分液漏斗通过分液操作分离即可,
故答案为:饱和的NaHSO3溶液;分液;
(6)在CH3CH2CH(OH)SO3Na 水溶液中存在平衡:CH3CH2CHO+NaHSO3═CH3CH2CH(OH)SO3Na,加入足量稀硫酸后,亚硫酸氢钠与稀硫酸反应生成硫酸钠、二氧化硫气体和水,亚硫酸氢钠减少,则平衡向着逆向移动,反应生成丙醛;可利用新制的氢氧化铜浊液检验丙醛,操作方法及现象为:取适量反应后的溶液于干净的试管中,加入过量的氢氧化钠溶液中和过量的硫酸并使溶液呈碱性,向试管中加入1mL新制的Cu(OH)2悬浊液,用酒精灯加热至沸腾,若出现砖红色沉淀,则证明反应后溶液中有CH3CH2CHO,
故答案为:CH3CH2CHO;取适量反应后的溶液于干净的试管中,加入过量的氢氧化钠溶液中和过量的硫酸并使溶液呈碱性,向试管中加入1mL新制的Cu(OH)2悬浊液,用酒精灯加热至沸腾,若出现砖红色沉淀,则证明反应后溶液中有CH3CH2CHO.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及化学方程式书写、化学平衡及其影响、性质实验方案的设计与评价等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.

| A. | 任何一个氧化还原反应都可以设计为原电池,输出电能 | |
| B. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率越大 | |
| D. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 |
| A. | X>Y>Z | B. | Y>X>Z | C. | X>Z>Y | D. | Y>Z>X |
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)已知下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
H2的燃烧热为285.8kJ/mol,1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为4725.8kJ.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256kJ 的热量.写出该反应的热化学方程式N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol,此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是生成N2和H2O,对环境无污染.
| A. | 乙烯使溴水褪色、乙酸乙酯在加热的条件下使含酚酞的NaOH溶液颜色变浅 | |
| B. | 由氯乙烯制聚氯乙烯、由纤维素制硝酸纤维 | |
| C. | 由油脂制甘油、由蛋白质制氨基酸 | |
| D. | 由甲苯制甲基环己烷、由乙烷制溴乙烷 |
 .
.