题目内容
10.(1)CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)已知下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
H2的燃烧热为285.8kJ/mol,1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为4725.8kJ.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256kJ 的热量.写出该反应的热化学方程式N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol,此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是生成N2和H2O,对环境无污染.
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并书写热化学方程式;
(2)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量;先根据方程式求出H2和C3H8的燃烧热,然后根据物质的量、燃烧热、热量三者之间的关系求解;
(3)强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热,依据题干条件结合化学方程式计算对应量的焓变,标注物质聚集状态写出热化学方程式;生成N2和H2O,对环境无污染.
解答 解:(1)在反应CH3-CH3→CH2=CH2+H2中,断裂6mol C-H键,1mol C-C键共吸收的能量为:6×414.4kJ+347.4kJ=2833.8kJ,生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414.4kJ+615.3kJ+435.3kJ=2708.2kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2833.8kJ-2708.2kJ=125.6,所以反应热为+125.6kJ/mol,所以热化学方程式为:CH3-CH3(g)→CH2=CH2(g)+H2(g)△H=+125.6 kJ•mol-1,
故答案为:CH3-CH3(g)→CH2=CH2(g)+H2(g)△H=+125.6 kJ•mol-1;
(2)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,所以1mol氢气完全燃烧生成液态水放出的热量为285.8kJ,则氢气的燃烧热为285.8kJ/mol,
已知氢气和丙烷燃烧热分别为:285.8kJ/mol、2220kJ/mol,所以1mol 氢气和2mol丙烷的混合气完全燃烧时放热为285.8kJ/mol×1mol+2220kJ/mol×2=4725.8kJ,
故答案为:285.8kJ/mol;4725.8kJ;
(3)0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256KJ的热量,1mol液态肼和过氧化氢反应放热640KJ;反应的热化学方程式为:
N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol,氮气为空气的主要成分,生成N2和H2O,对环境无污染,
故答案为:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol;生成N2和H2O,对环境无污染.
点评 本题考查反应热的计算,题目难度中等,注意把握从键能的角度计算反应热的方法,抓住物质的量、燃烧热、热量三者之间的关系是解题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 | |
| B. | 用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染 | |
| C. | 火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电 | |
| D. | 绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放 |
| A. | 钢铁制品表面水膜的酸性较强时,正极的电极反应:2H++2e-═H2↑ | |
| B. | 常温下,氯化铵溶液呈酸性:NH4++OH-?NH3•H2O | |
| C. | 向硫酸镁溶液中加入Ba(OH)2溶液,将溶液中的SO42-完全沉淀下来:SO42-+Ba2+═BaSO4↓ | |
| D. | 向氯化银浊液中加入硫化钠溶液产生黑色沉淀:2Ag++S2-═Ag2S↓ |
| A. | NF3的摩尔质量为71g | |
| B. | 还原剂和氧化剂的物质的量之比是2:1 | |
| C. | 若生成0.2mol HNO3,则转移0.2mol电子 | |
| D. | NF3在潮湿的空气中泄漏可观察到红棕色气体 |
| A. | 山梨酸易溶于四氯化碳 | |
| B. | 山梨酸能与氢气发生加成反应 | |
| C. | 山梨酸能和乙醇反应生成酯 | |
| D. | 1mol山梨酸能和金属钠反应生成1mol氢气 |
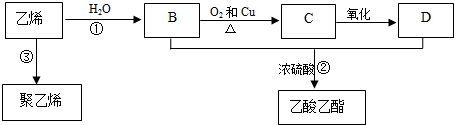
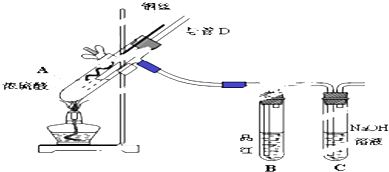
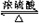 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. +CaCl2+H2O
+CaCl2+H2O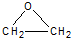
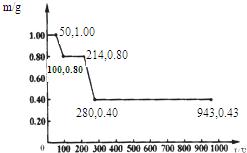 (1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下:
(1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下: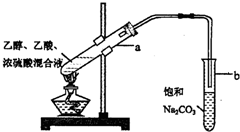
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.