题目内容
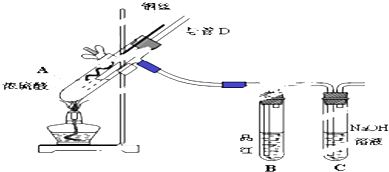
15.(1)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,其化学方程式如下:3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O,反应生成的氧化产物与还原产物分子个数之比为1:3.(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,(2)加入Na2CO3,有气泡产生,由此可判断出该钠盐A为NaHSO4(化学式),写出有关离子方程式Ba2++SO42-=BaSO4↓,CO32-+2H+=H2O+CO2↑.
分析 (1)反应中N元素的化合价升高,则氧化产物为N2,S元素的化合价降低,还原产物为SO2,根据方程式中物质的计量数关系判断.
(2)根据现象可知该钠盐中含有硫酸根离子和氢离子,即为硫酸氢钠,据此分析.
解答 解:(1)3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O,反应中N元素的化合价升高,则氧化产物为N2,S元素的化合价降低,还原产物为SO2,根据方程式可知,
氧化产物与还原产物分子个数之比为1:3.
故答案为:1:3;
(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,说明含有硫酸根,(2)加入Na2CO3,有气泡产生,说明含有氢离子,由此可判断出该钠盐A为NaHSO4;反应的离子方程式为:Ba2++SO42-=BaSO4↓、CO32-+2H+=H2O+CO2↑;
故答案为:NaHSO4;Ba2++SO42-=BaSO4↓、CO32-+2H+=H2O+CO2↑.
点评 本题考查学生氧化还原反应中的基本概念和电子守恒的应用、离子反应等知识,注意把握氧化还原反应原理,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.甲基苯基甲醇(Methylphenylcarbinol)可以用作食用香精,其结构简式为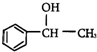 则甲基苯基甲醇的分子式为( )
则甲基苯基甲醇的分子式为( )
 则甲基苯基甲醇的分子式为( )
则甲基苯基甲醇的分子式为( )| A. | C8H10O | B. | C9H10O | C. | C8H8O | D. | C8H12O |
3.无机非金属材料的品种繁多,用途各异.下列物质中属于无机非金属材料的是( )
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
7.下列有关说法正确的是( )
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
6.下列实验装置图能完成相应实验的是( )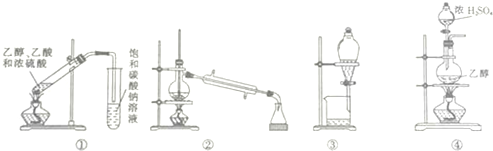

| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和甲苯 | |
| C. | 装置③可用于分离碘的四氯化碳溶液 | |
| D. | 装置④可用于实验室制取乙烯 |

 (1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下:
(1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下: