题目内容
14.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: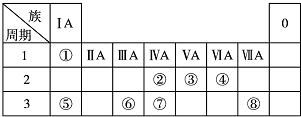
(1)地壳中含量最高的金属元素在周期表中的位置是第3周期ⅢA族.
(2)⑧形成的单质与水反应的离子方程式为Cl2+H2O?HClO+H++Cl-.
(3)②⑦的非金属性强弱可通过比较这两种元素a、c(填编号)
a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(4)写出一种由④⑤⑧元素形成的既含有离子键又含有共价键的物质的电子式
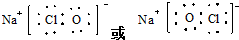 .
.(5)化工行业最近合成了由元素②和③形成的化合物,其硬度比金刚石还大.该物质所形成的晶体还可能具有的性质或特点有①③④(填编号)
①熔点很高 ②可以导电③不存在单个分子 ④具有空间网状结构
(6)①和③形成的某液态化合物摩尔质量与氧气相同.在常温常压下0.25mol该液态物质在足量的氧气中完全燃烧生成③的气态单质和液态水,同时放出QkJ的热量.写出该反应的热化学方程式N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-4QkJ•mol-1.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)地壳中含量最高的金属元素为铝元素;
(2)⑧形成的单质为氯气,氯气与水反应生成盐酸和次氯酸;
(3)元素的非金属性越强,原子的得电子的能力就越强,最高价的含氧酸的酸性就越强,气态氢化物的稳定性也越强;
(4)由④⑤⑧元素形成的既含有离子键又含有共价键的物质为次氯酸钠等;
(5)化工行业最近合成了由元素②和③形成的化合物,其硬度比金刚石还大,则该物质所形成的晶体为原子晶体,根据原子晶休可能具有的性质或特点判断;
(6)①和③形成的某液态化合物摩尔质量与氧气相同,则该物质为N2H4,在常温常压下0.25mol该液态物质在足量的氧气中完全燃烧生成氮气和液态水,同时放出QkJ的热量,则1molN2H4反应可放出4QkJ的热量,据此写出反应的热化学方程式.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)地壳中含量最高的金属元素为铝元素,铝元素在周期表中的位置是第3周期ⅢA族,
故答案为:第3周期ⅢA族;
(2)⑧形成的单质为氯气,氯气与水反应生成盐酸和次氯酸,反应的离子方程式为Cl2+H2O?HClO+H++Cl-,
故答案为:Cl2+H2O?HClO+H++Cl-;
(3)元素的非金属性越强,原子的得电子的能力就越强,最高价的含氧酸的酸性就越强,气态氢化物的稳定性也越强,所以a、c正确,
故答案为:a、c;
(4)由④⑤⑧元素形成的既含有离子键又含有共价键的物质为次氯酸钠,其电子式为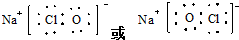 ,
,
故答案为: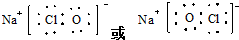 ;
;
(5)化工行业最近合成了由元素②和③形成的化合物,其硬度比金刚石还大,则该物质所形成的晶体为原子晶体,根据原子晶休可知,该物质熔点很高、不存在单个分子、具有空间网状结构,
故选:①③④;
(6)①和③形成的某液态化合物摩尔质量与氧气相同,则该物质为N2H4,在常温常压下0.25mol该液态物质在足量的氧气中完全燃烧生成氮气和液态水,同时放出QkJ的热量,则1molN2H4反应可放出4QkJ的热量,该反应的热化学方程式为N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-4Q kJ•mol-1,
故答案为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-4Q kJ•mol-1.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
| A. | 钢铁制品表面水膜的酸性较强时,正极的电极反应:2H++2e-═H2↑ | |
| B. | 常温下,氯化铵溶液呈酸性:NH4++OH-?NH3•H2O | |
| C. | 向硫酸镁溶液中加入Ba(OH)2溶液,将溶液中的SO42-完全沉淀下来:SO42-+Ba2+═BaSO4↓ | |
| D. | 向氯化银浊液中加入硫化钠溶液产生黑色沉淀:2Ag++S2-═Ag2S↓ |
| A. | 煤的干馏和石油的分馏都属化学变化 | |
| B. | 硫酸钡在医学上用作钡餐,钡离子对人体无害 | |
| C. | 碳-14可用作文物年代的鉴定,碳-14与碳-12互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| A. | NF3的摩尔质量为71g | |
| B. | 还原剂和氧化剂的物质的量之比是2:1 | |
| C. | 若生成0.2mol HNO3,则转移0.2mol电子 | |
| D. | NF3在潮湿的空气中泄漏可观察到红棕色气体 |
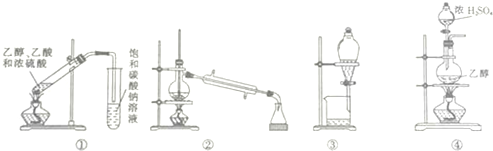
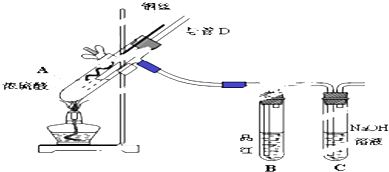
| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和甲苯 | |
| C. | 装置③可用于分离碘的四氯化碳溶液 | |
| D. | 装置④可用于实验室制取乙烯 |
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有Na+的物质的量为0.1mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | 标准状况下,22.4 L盐酸含有NA个HCl分子 |
| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质的氧化性随核电荷数的增加而增强 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而增强 |