题目内容
12.不纯的金属X混有Z金属,生锈时X先腐蚀,将X、Y组成原电池时,X是电池的正极,则X、Y、Z三种金属活动性的是( )| A. | X>Y>Z | B. | Y>X>Z | C. | X>Z>Y | D. | Y>Z>X |
分析 在原电池中,一般来说,作负极的金属活泼性较强,较不活泼的金属作正极,根据原电池中正负极判断金属活泼性强弱;在金属活动性顺序表中,较活泼的金属首先被腐蚀,据此分析解答.
解答 解:原电池中,一般来说,作负极的金属活泼性较强,较不活泼的金属作正极,根据原电池中正负极判断金属活泼性强弱;在金属活动性顺序表中,较活泼的金属首先被腐蚀;
不纯的金属X混有Z金属,生锈时X先腐蚀,说明活泼性X>Z;
将X、Y组成原电池时,X是电池的正极,则金属活泼性Y>X,
通过以上分析知,金属活动性强弱顺序是Y>X>Z,
故选B.
点评 本题考查金属活动性强弱顺序判断,为高频考点,明确原电池中正负极与金属活泼性关系是解本题关键,还可以根据金属最高价氧化物的水化物碱性强弱、金属之间的置换反应判断金属性强弱,题目难度不大.

练习册系列答案
相关题目
3.无机非金属材料的品种繁多,用途各异.下列物质中属于无机非金属材料的是( )
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
7.下列有关说法正确的是( )
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
2.下列表示对应化学反应的离子方程式正确的是( )
| A. | 钢铁制品表面水膜的酸性较强时,正极的电极反应:2H++2e-═H2↑ | |
| B. | 常温下,氯化铵溶液呈酸性:NH4++OH-?NH3•H2O | |
| C. | 向硫酸镁溶液中加入Ba(OH)2溶液,将溶液中的SO42-完全沉淀下来:SO42-+Ba2+═BaSO4↓ | |
| D. | 向氯化银浊液中加入硫化钠溶液产生黑色沉淀:2Ag++S2-═Ag2S↓ |
3.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有Na+的物质的量为0.1mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | 标准状况下,22.4 L盐酸含有NA个HCl分子 |
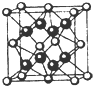 已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答: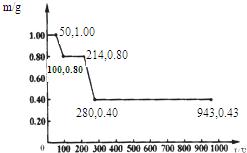 (1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下:
(1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下: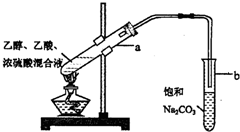
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.