题目内容
17.中国是世界上最早研究和生产合金的国家之一.①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点低.
②铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式Cu-2e-=Cu2+;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O.
③下列对金属制品采取的防护方法不正确的是C(填序号).
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块.
分析 ①钠、钾在常温下呈固态,而合金在常温下呈液态来判断熔点;
②铜腐蚀时做负极时失去电子;铜绿是碱式碳酸铜可与盐酸反应;
③A.外面包上一层塑料层可减少与空气的接触;
B.镀上一层金属铬可以隔绝空气;
C.原电池能加快化学反应速率
解答 解:①钠、钾在常温下呈固态,而合金在常温下呈液态来判断,说明合金的熔点比其成分金属的熔点低,
故答案为:低;
②铜腐蚀时做负极时失去电子生成铜离子:Cu-2e-=Cu2+;铜绿是碱式碳酸铜可与盐酸反应生成氯化铜、二氧化碳和水:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O,
故答案为:Cu-2e-=Cu2+; Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O;
③A.外面包上一层塑料层可减少与空气中氧气的接触,故A正确;
B.镀上一层金属铬可以隔绝空气,使金属不受腐蚀,故B正确;
C.原电池能加快化学反应速率,铁铜海水构成原电池,Fe作负极被腐蚀,加快铁的腐蚀,故C错误.
点评 本题考查合金、铜的腐蚀、金属腐蚀的防护等,题目难度不大,注意把握原电池原理以及正负极的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列有关说法正确的是( )
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
2.下列表示对应化学反应的离子方程式正确的是( )
| A. | 钢铁制品表面水膜的酸性较强时,正极的电极反应:2H++2e-═H2↑ | |
| B. | 常温下,氯化铵溶液呈酸性:NH4++OH-?NH3•H2O | |
| C. | 向硫酸镁溶液中加入Ba(OH)2溶液,将溶液中的SO42-完全沉淀下来:SO42-+Ba2+═BaSO4↓ | |
| D. | 向氯化银浊液中加入硫化钠溶液产生黑色沉淀:2Ag++S2-═Ag2S↓ |
9.化学与生活密切相关,下列有关说法正确的是( )
| A. | 煤的干馏和石油的分馏都属化学变化 | |
| B. | 硫酸钡在医学上用作钡餐,钡离子对人体无害 | |
| C. | 碳-14可用作文物年代的鉴定,碳-14与碳-12互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
6.下列实验装置图能完成相应实验的是( )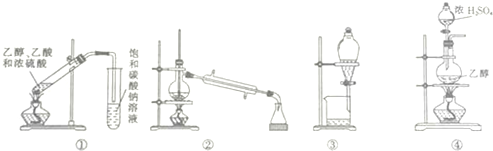

| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和甲苯 | |
| C. | 装置③可用于分离碘的四氯化碳溶液 | |
| D. | 装置④可用于实验室制取乙烯 |
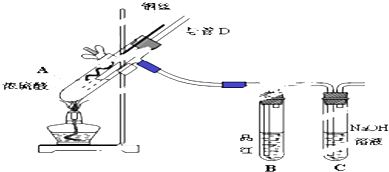
7.我国高速铁路技术世界领先.高速铁路的无缝钢轨是将钢轨间的接头用铝与氧化铁发生铝热反应进行焊接而成的.对于铝热反应:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3,下列说法中正确的是( )
| A. | Fe2O3是还原剂 | B. | Al被还原 | ||
| C. | Fe2O3发生还原反应 | D. | 反应中转移3个电子 |