题目内容
3.下列有关化学用语表示正确的是( )| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: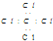 | D. | F原子的电子式: |
分析 A.将电子式中的所有共用电子对用短线表示即为结构式,结合氮气的电子式判断其结构式;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.四氯化碳的电子式中漏掉了氯原子的3对孤电子对;
D.氟原子的最外层含有7个电子.
解答 解:A.氮气中氮原子之间通过三键均达到了8电子稳定结构,其电子式为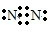 ,将电子式中的所有共用电子对用短线表示即为结构式,则氮气的结构式为:N≡N,故A错误;
,将电子式中的所有共用电子对用短线表示即为结构式,则氮气的结构式为:N≡N,故A错误;
B.氯元素的质子数为17,中子数为20的氯原子的质量数为37,该氯原子的正确表示方法为:1737Cl,故B错误;
C.四氯化碳中碳原子和氯原子均满足8电子稳定结构,其正确的电子式为: ,故C错误;
,故C错误;
D.F原子最外层含有7个电子,其电子式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的书写方法,题目难度中等,注意掌握电子式、元素符号的概念及书写原则,明确四氯化碳与甲烷的电子式的区别,试题培养了学生规范答题的能力.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
13.已知断裂1mol共价键所需要吸收的能量分别为:H-H:436kJ,I-I:151kJ,H-I:299kJ,下列对H2(g)+I2(g)?2HI(g)的反类型判断错误的是( )
| A. | 放热反应 | B. | 吸热反应 | C. | 氧化还原反应 | D. | 可逆反应 |
14.下列化合中,即有离子键又有共价键的是( )
| A. | H2O | B. | CaO | C. | NaCl | D. | NaOH |
18.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 SO2 | B. | C2H4 CH4 | C. | C60 C2H4 | D. | NH3 HCl |
8.下列各项中表达正确的是( )
| A. | S原子结构示意图: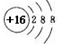 | |
| B. | 二氧化碳的电子式: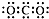 | |
| C. | H、D、T表示同一种核素 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ |
12.以惰性电极电解 CuSO4 溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为.( )
| A. | 0.64g | B. | 1.28g | C. | 2.56g | D. | 5.12g |
13.向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸.下列离子方程式与事实不相符的是( )
| A. | OH-+CO32-+2H+→HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+2H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
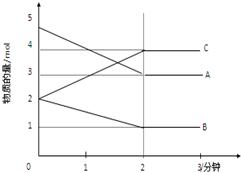 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体). .
.