题目内容
13.已知断裂1mol共价键所需要吸收的能量分别为:H-H:436kJ,I-I:151kJ,H-I:299kJ,下列对H2(g)+I2(g)?2HI(g)的反类型判断错误的是( )| A. | 放热反应 | B. | 吸热反应 | C. | 氧化还原反应 | D. | 可逆反应 |
分析 依据H2(g)+I2(g)?2HI(g)可知,反应前后化合价发生变化,又是可逆符号,所以该反应既是氧化还原反应又是可逆反应,再根据△H=反应物的键能和-生成物的键能和计算判断是吸热还是放热反应.
解答 解:由H2(g)+I2(g)?2HI(g)可知,反应前后化合价发生变化,又是可逆符号,所以该反应既是氧化还原反应又是可逆反应,则C、D正确;
又反应方程式H2(g)+I2(g)=2HI(g),其△H=反应物的键能和-生成物的键能和解答=436KJ/mol+151KJ/mol-2×299KJ/mol=-11KJ/mol,焓变小于0,所以为放热反应,则A正确,B错误;
故选:B.
点评 本题主要考查通过反应物和生成物的键能计算焓变,及△H=反应物的键能和-生成物的键能和解答,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
8.关于某溶液所含离子检验的方法和结论正确的是( )
| A. | 加入BaCl2溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有SO42- | |
| B. | 加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有Cl- | |
| C. | 加入盐酸产生能使澄清石灰水变浑浊的气体,原溶液中可能有CO32-或SO32- | |
| D. | 加入NaOH并加热,产生使湿润蓝色石蕊试纸变红的气体,原溶液是铵盐溶液 |
5.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 电子层数越多的原子半径越大 | |
| C. | 同周期非金属氧化物对应的水化物酸性从左到右依次增强 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的沸点也最高 |
2.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好一次通过盛有以下哪种试剂的洗气瓶( )
| A. | 澄清石灰水,浓硫酸 | B. | 酸性高锰酸钾溶液,浓硫酸 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓硫酸,酸性高锰酸钾溶液 |
3.下列有关化学用语表示正确的是( )
| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: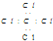 | D. | F原子的电子式: |
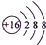
 上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.
上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.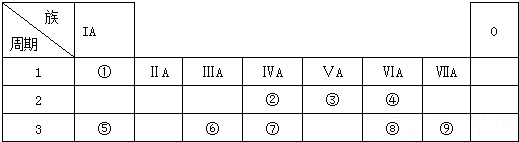
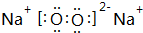 ,含有的化学键类型有离子键、共价键
,含有的化学键类型有离子键、共价键 ,名称是环己烷.
,名称是环己烷.