题目内容
14.下列化合中,即有离子键又有共价键的是( )| A. | H2O | B. | CaO | C. | NaCl | D. | NaOH |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物和铵盐中含有离子键,据此分析解答.
解答 解:A.水分子中H-O原子之间只存在共价键,故A错误;
B.氧化钙中钙离子和氧离子之间只存在离子键,故B错误;
C.氯化钠中钠离子和氯离子之间只存在离子键,故C错误;
D.氢氧化钠中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故D正确;
故选D.
点评 本题考查离子键和共价键判断,侧重考查基本概念,根据物质的构成微粒及微粒之间作用力判断即可,注意不能根据是否含有金属元素判断离子键,为易错点.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
5.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 电子层数越多的原子半径越大 | |
| C. | 同周期非金属氧化物对应的水化物酸性从左到右依次增强 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的沸点也最高 |
2.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好一次通过盛有以下哪种试剂的洗气瓶( )
| A. | 澄清石灰水,浓硫酸 | B. | 酸性高锰酸钾溶液,浓硫酸 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓硫酸,酸性高锰酸钾溶液 |
9.下列各分子中,化学键类型不同的是( )
| A. | H2O、CO | B. | MgF2、H2O | C. | KOH、Mg(OH)2 | D. | HCl、HBr |
19.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3CHO→C2H5OH | B. | C2H5Cl→CH2=CH2 | ||
| C. | C3H7Br→C3H7OH | D. | CH3COOH→CH3COOC2H5 |
6.X元素的阳离子和Y元素的阴离子都具有与Ar原子相同的电子层结构,下列叙述正确的是( )
| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
3.下列有关化学用语表示正确的是( )
| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: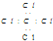 | D. | F原子的电子式: |
4.下列说法不正确的是( )
| A. | 冰→水若自发进行,△H<T△S | B. | 水→冰若自发进行,△H<0 | ||
| C. | 冰?水的平衡状态△H=T△S | D. | 水?冰的平衡状态,△H=0 |
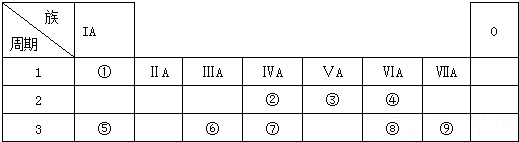
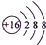
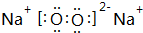 ,含有的化学键类型有离子键、共价键
,含有的化学键类型有离子键、共价键