题目内容
13.向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸.下列离子方程式与事实不相符的是( )| A. | OH-+CO32-+2H+→HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+2H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
分析 等物质的量浓度的NaOH和Na2CO3的混合溶液中含有氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,盐酸少量时发生反应CO32-+H+→HCO3-,盐酸过量时发生反应:CO32-+2H+→CO2↑+H2O,据此进行解答.
解答 解:根据题意可知,等物质的量浓度的NaOH和Na2CO3的混合溶液中,含有的氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,
A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+H+→HCO3-,将两个方程式相加得:OH-+CO32-+2H+→HCO3-+H2O,故A正确;
B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH-+2H+→2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应CO32-+H+→HCO3-,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:2OH-+CO32-+3H+→HCO3-+2H2O,故B正确;
C.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为2OH-+2CO32-+4H+→2HCO3-+2H2O,即OH-+CO32-+2H+→HCO3-+H2O,故C错误;
D.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+2H+→CO2↑+H2O,将两个方程式相加得:OH-+CO32-+3H+→CO2↑+2H2O,故D正确;
故选C.
点评 本题考查了离子方程式的书写,题目难度中等,明确氢氧根离子、碳酸根离子与氢离子反应的顺序和过程是解题关键,注意反应物的量对生成物的影响.

| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: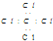 | D. | F原子的电子式: |
| A. | 冰→水若自发进行,△H<T△S | B. | 水→冰若自发进行,△H<0 | ||
| C. | 冰?水的平衡状态△H=T△S | D. | 水?冰的平衡状态,△H=0 |
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物.
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
| A. | 海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg | |
| B. | 海水$\stackrel{HCl}{→}$MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{BCl}{→}$ MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg |
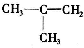 、CH3CH=CHCH3和CH3CH2CH=CH2.
、CH3CH=CHCH3和CH3CH2CH=CH2. ,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
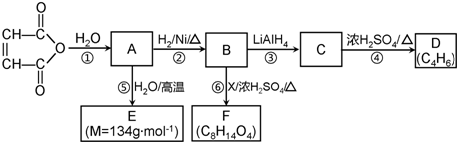

 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O. 、
、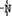 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.