题目内容
11.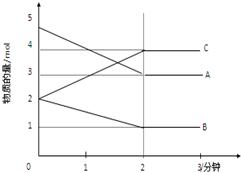 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).(1)该反应的化学方程式为2A+B?2C;
(2)反应开始至2分钟时,B的平均反应速率为0.1mol/(L.min).
(3)能说明该反应已达到平衡状态的是b.
a.v(A)=2v(B) b.容器内压强保持不变
c.2v逆(A)=v正(B) d.容器内混合气体的密度保持不变
(4)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,当改变下列条件时,反应速率会减小的是AC
A.降低温度 B.加入催化剂 C.增大容器体积.
分析 (1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(2)化学反应速率是单位时间内浓度的变化,据V=$\frac{△c}{△t}$计算反应速率;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,据此判断;
(4)减小浓度,降低温度或者降压可以使反应速率会减小.
解答 解:(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数成正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B?2C,
故答案为:2A+B?2C;
(2)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为$\frac{\frac{1mol}{5L}}{2min}$=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(3)a、v(A)=2v(B)不能说明正反应和逆反应的关系,故无法判断反应是否达到平衡,故a错误;
b、该反应为前后气体体积变小的反应,随着正反应的进行,气体物质的量不断减小,压强也减小,当压强不变时,说明反应已达平衡状态,故b正确;
c、在该反应中A和B的计量数之比为2:1,所以当v逆(A)=2v正(B)时,可以说明反应已达平衡状态了,故c错误;
d、该反应在5L恒容容器中进行,所有物质又都是气体,所以反应体系的密度始终不变,所以不能作为平衡状态的判断标志,故d错误;
故答案为:b;
(3)A.降低温度,反应速率减小,故A正确;
B.加入催化剂,一般增大反应速率,故B错误;
C.增大容器体积,则减小浓度,反应速率减小,故C正确;
故选:AC;
点评 本题考查化学实验及化学平衡图象问题,题目难度中等,注意把握由图象判断化学方程式的方法以及反应现象与结论的推断.

| A. | 澄清石灰水,浓硫酸 | B. | 酸性高锰酸钾溶液,浓硫酸 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓硫酸,酸性高锰酸钾溶液 |
| A. | CH3CHO→C2H5OH | B. | C2H5Cl→CH2=CH2 | ||
| C. | C3H7Br→C3H7OH | D. | CH3COOH→CH3COOC2H5 |
| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: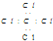 | D. | F原子的电子式: |
 ,名称是环己烷.
,名称是环己烷.
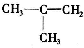 、CH3CH=CHCH3和CH3CH2CH=CH2.
、CH3CH=CHCH3和CH3CH2CH=CH2. ,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.