题目内容
18.下列各组分子中,都属于含极性键的非极性分子的是( )| A. | CO2 SO2 | B. | C2H4 CH4 | C. | C60 C2H4 | D. | NH3 HCl |
分析 非极性键为:同种元素的原子间形成的共价键;极性键为:不同元素的原子间形成的共价键;极性分子为:正电荷中心和负电荷中心不相重合的分子;非极性分子:正电荷中心和负电荷中心相重合的分子;分子极性的判断方法为:分子的极性由共价键的极性及分子的空间构型两个方面共同决定.
A、二氧化碳为极性键形成的非极性分子,二氧化硫为极性键形成的极性分子;
B、C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子,CH4 中含有极性键,为正四面体结构,结构对称,分子中正负电荷重心重叠,为非极性分子;
C、C60中只含有非极性键,为非极性分子;C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子;
D、氨气和氯化氢都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,属于极性分子.
解答 解:A、二氧化碳为极性键形成的非极性分子,因为二氧化硫中中心原子硫有孤对电子,所以二氧化硫为极性键形成的极性分子,故A错误;
B、C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子,CH4 中含有极性键,为正四面体结构,结构对称,分子中正负电荷重心重叠,为非极性分子,故B正确;
C、C60中只含有非极性键,为非极性分子;C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故C错误;
D、氨气和氯化氢都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,属于极性分子,故D错误.
故选:B.
点评 本题考查了键的极性和分子的极性判断,题目难度不大,侧重于对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
8.关于某溶液所含离子检验的方法和结论正确的是( )
| A. | 加入BaCl2溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有SO42- | |
| B. | 加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有Cl- | |
| C. | 加入盐酸产生能使澄清石灰水变浑浊的气体,原溶液中可能有CO32-或SO32- | |
| D. | 加入NaOH并加热,产生使湿润蓝色石蕊试纸变红的气体,原溶液是铵盐溶液 |
9.下列各分子中,化学键类型不同的是( )
| A. | H2O、CO | B. | MgF2、H2O | C. | KOH、Mg(OH)2 | D. | HCl、HBr |
6.X元素的阳离子和Y元素的阴离子都具有与Ar原子相同的电子层结构,下列叙述正确的是( )
| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
13.根据下列实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该实验中一定没有添加KIO3 |
| D | 向苯酚钠溶液滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
3.下列有关化学用语表示正确的是( )
| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: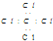 | D. | F原子的电子式: |
10.下列各组三种元素中,属于同一周期的是( )
| A. | C、H、O | B. | F、Cl、Br | C. | Li、Be、B | D. | Si、S、P |
7.把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后溶液显示弱酸性,则混合液中微粒浓度关系不正确的为( )
| A. | c(CH3COO-)>c(Na+) | B. | c(Na+)=c(CH3COO-)+c(CH3COOH) | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
8. “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |