题目内容
15.写出符合下列要求的化学方程式:(1)除去乙烷中混有的乙烯:C2H4+Br2→CH2BrCH2Br.
(2)由甲苯制备梯恩梯(TNT):
 .
.(3)苯甲醛为最简单的芳香醛,通常可用银氨溶液检验:C6H5CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$C6H5COONH4+H2O+2Ag↓+3NH3↑.
(4)2-氯丙烷与NaOH乙醇溶液共热的反应:CH3CHClCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaCl+H2O.
(5)利用纯碱溶液鉴别乙醇中是否混有乙酸:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O.
分析 (1)乙烷不能与溴单质反应,而乙烯含有碳碳双键能与溴发生加成反应,除去乙烷中混有的乙烯通过溴水,乙烯和溴单质反应生成1,2-二溴乙烷;
(2)甲苯在浓硫酸作用下可与浓硝酸发生取代反应生成TNT;
(3)醛基可用银氨试剂进行检验,芳香醛和银氨试剂发生氧化还原反应生成银镜,可检验醛基的存在;
(4)卤代烃发生消去反应的结构特点:与-X所连碳相邻碳上有氢原子的才能发生消去反应,形成不饱和键;
(5)利用纯碱溶液鉴别乙醇中是否混有乙酸,乙醇和水混溶,乙酸与碳酸钠反应生产气体.
解答 解:(1)乙烯含有碳碳双键能与溴发生加成反应,从而除去乙烷中混有的乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,反应方程式为C2H4+Br2→CH2 BrCH2Br.
故答案为:C2H4+Br2→CH2BrCH2Br
(2)甲苯在浓硫酸作用下可与浓硝酸反应生成TNT,反应的化学方程式为 ,
,
故答案为: ;
;
(3)醛基能被弱氧化剂银氨试剂氧化成羧酸同时同时生成银镜,反应为C6H5CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$C6H5COONH4+H2O+2Ag↓+3NH3↑,
故答案为:C6H5CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$C6H5COONH4+H2O+2Ag↓+3NH3↑;
(4)2-氯丙烷与NaOH乙醇溶液共热,连卤原子的碳原子的相邻碳原子上的一个氢原子和卤素原子同时消去生成烯烃,反应为:CH3CHClCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaCl+H2O,
故答案为:CH3CHClCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaCl+H2O;
(5)乙酸的酸性强于碳酸,利用纯碱溶液鉴别乙醇中是否混有乙酸,乙酸与碳酸钠反应2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O,
故答案为:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O.
点评 本题考查了有机物的性质,题目难度不大,掌握乙烯的加成、甲苯的取代、醛基的银镜反应、卤代烃的消去、乙酸的性质是解答的关键,注意对有机反应机理的理解.

 考前必练系列答案
考前必练系列答案| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 电子层数越多的原子半径越大 | |
| C. | 同周期非金属氧化物对应的水化物酸性从左到右依次增强 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的沸点也最高 |
| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: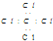 | D. | F原子的电子式: |
| A. | C、H、O | B. | F、Cl、Br | C. | Li、Be、B | D. | Si、S、P |
| A. | c(CH3COO-)>c(Na+) | B. | c(Na+)=c(CH3COO-)+c(CH3COOH) | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
| A. | 冰→水若自发进行,△H<T△S | B. | 水→冰若自发进行,△H<0 | ||
| C. | 冰?水的平衡状态△H=T△S | D. | 水?冰的平衡状态,△H=0 |


 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O.