题目内容
14.下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:(除特别注明外,其它一律用化学式表示)| A | |||||||||||||||||
| W | T | M | F | ||||||||||||||
| B | D | Z | J | L | H | V | |||||||||||
| C | E | G | Q | ||||||||||||||
(2)属于过渡元素的是G(填字母),H在周期表中的位置第三周期第ⅥA族.
(3)某元素二价阳离子的核外有10个电子,该元素是镁(填元素名称)
(4)L、M、T形成的气态氢化物化合物稳定性由强到弱的顺序H2O>NH3>PH3,J、L、H的最高价氧化物对应水化物的酸性由强到弱的顺序H2SO4>H3PO4>H2SiO3.
(5)D、M、W、E原子半径由大到小的顺序Ca>Mg>C>O.
(6)写出Z单质与B最高价氧化物对应水化物相互反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 由元素在周期表的位置可知,A为H,B为Na,C为K,D为Mg,E为Ca,F为Ne,G为Cu,Z为Al,W为C,J为Si,T为N,L为P,M为O,H为S,V为Cl,Q为Br,
(1)原子结构中最外层为8电子稳定结构的性质稳定;上述元素中K的金属最强;
(2)只有G为过渡元素,H为S,原子结构中含3个电子层、最外层电子数为6;
(3)Mg的二价阳离子的核外有10个电子;
(4)非金属性越强,气态氢化物越稳定、最高价氧化物对应水化物的酸性越强;
(5)电子层越多,原子半径越大;相同周期的元素,原子序数大的原子半径小;
(6)Z为Al,B最高价氧化物对应水化物为NaOH,反应生成偏铝酸钠和氢气.
解答 解:由元素在周期表的位置可知,A为H,B为Na,C为K,D为Mg,E为Ca,F为Ne,G为Cu,Z为Al,W为C,J为Si,T为N,L为P,M为O,H为S,V为Cl,Q为Br,
(1)上述元素的单质中,化学性质最不活泼的单质是Ne;上述元素中K的金属最强,则KOH的碱性最强,故答案为:Ne;KOH;
(2)只有G(Cu)为过渡元素,H为S,原子结构中含3个电子层、最外层电子数为6,S位于第三周期第ⅥA族,故答案为:G;三;ⅥA;
(3)Mg的二价阳离子的核外有10个电子,该元素为镁,故答案为:镁;
(4)非金属性O>N>P,气态氢化物的稳定性为H2O>NH3>PH3,非金属性S>P>Si,最高价氧化物对应水化物的酸性为H2SO4>H3PO4>H2SiO3,
故答案为:H2O>NH3>PH3;H2SO4>H3PO4>H2SiO3;
(5)电子层越多,原子半径越大;相同周期的元素,原子序数大的原子半径小,则原子半径为Ca>Mg>C>O,故答案为:Ca>Mg>C>O;
(6)Z为Al,B最高价氧化物对应水化物为NaOH,反应生成偏铝酸钠和氢气,则离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| B. | l.0 mol•L-1 NaClO溶液:Fe2+、K+、I-、Cl- | |
| C. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 在c(OH-)/c(H+)=1×1013的溶液:NH4+、Ca2+、C1-、K+ |
①液氨汽化时要吸收大量的热,可用作制冷剂
②NO和O2反应生成NO2属于氮的固定
③可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气
④检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
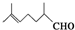 甜瓜醛是调制西瓜、甜瓜、黄瓜、柠檬、苹果等味道的食用香精.其结构简式如图所示.下列有关甜瓜醛的叙述正确的是( )
甜瓜醛是调制西瓜、甜瓜、黄瓜、柠檬、苹果等味道的食用香精.其结构简式如图所示.下列有关甜瓜醛的叙述正确的是( )| A. | 该物质最多可与1 mol氢气发生加成反应 | |
| B. | 该物质的分子式为C9H14O | |
| C. | 加热条件下,该物质能与新制Cu(OH)2悬浊液反应 | |
| D. | 该物质为烯烃 |
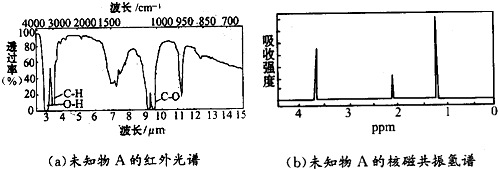
| A. | CH3CH2OH | B. | CH3OCH3 | C. | CH3 COOH | D. | CH3CHO |
| A. | 1.0 mol | B. | 1.5 mol | C. | 2.0 mol | D. | 2.5 mol |
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能 | |
| B. | 乙醇电离出H+的能力不及H2O | |
| C. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |