题目内容
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| B. | l.0 mol•L-1 NaClO溶液:Fe2+、K+、I-、Cl- | |
| C. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 在c(OH-)/c(H+)=1×1013的溶液:NH4+、Ca2+、C1-、K+ |
分析 A.酸性条件下,离子之间不发生任何反应;
B.ClO-具有强氧化性;
C.甲基橙显黄色的溶液,可能呈酸性、中性、碱性;
D.c(OH-)/c(H+)=1×1013的溶液呈碱性.
解答 解:A.醋酸溶液呈酸性,酸性条件下,离子之间不发生任何反应,可大量共存,故A正确;
B.ClO-具有强氧化性,具有还原性的Fe2+、I-不能大量共存,故B错误;
C.甲基橙的变色范围为3.1-4.4,显黄色的溶液,可能呈酸性、中性、碱性,酸性条件下,NO3-、SO32-发生氧化还原反应,且CO32-不能大量存在于酸性条件下,故C错误;
D.c(OH-)/c(H+)=1×1013的溶液呈碱性,碱性条件下NH4+不能大量共存,故D错误.
故选A.
点评 本题考查离子共存问题,为高频考点,题目难度中等,本题注意把握相关题给信息,为解答该类题目的关键,学习中注重相关基础知识的积累.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
10.对于反应2H2O2═2H2O+O2↑,下列措施能加快该反应速率的是( )
| A. | 减小压强 | B. | 加热 | C. | 加水稀释 | D. | 降低温度 |
11.下列离子方程式书写不正确的是( )
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
8.液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池.正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液.下列有关说法不正确的是( )
| A. | 将LiCoO2改写成为氧化物的形式为Li2O•Co2O3 | |
| B. | 该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性 | |
| C. | Li是3号元素,是最轻的金属之一,这类电池质能比高 | |
| D. | 在电池充放电时,Li+在两个电极之间往返嵌入和脱嵌.该电池的充放电反应方程式为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6 |
15.能正确表示下列反应的离子方程式是( )
| A. | 用氨水吸收过量的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | Ca(HCO3)2 溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO |
12.分子式为C10H14的二取代芳烃,其可能的结构有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 10种 |
13.为验证氧化性Cl2>Fe3+>SO2,某小组用如图1所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
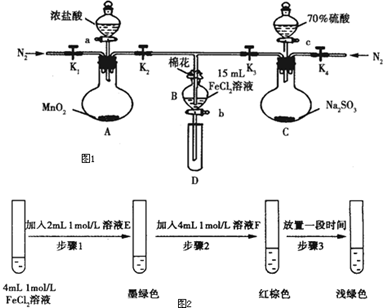
实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
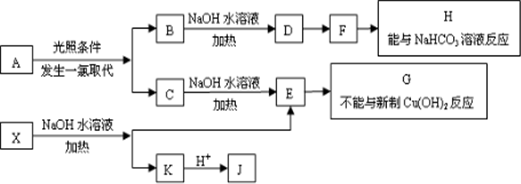
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.
14.下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:(除特别注明外,其它一律用化学式表示)
(1)化学性质最不活泼的单质是Ne,最高价氧化物水化物中碱性最强的是KOH.
(2)属于过渡元素的是G(填字母),H在周期表中的位置第三周期第ⅥA族.
(3)某元素二价阳离子的核外有10个电子,该元素是镁(填元素名称)
(4)L、M、T形成的气态氢化物化合物稳定性由强到弱的顺序H2O>NH3>PH3,J、L、H的最高价氧化物对应水化物的酸性由强到弱的顺序H2SO4>H3PO4>H2SiO3.
(5)D、M、W、E原子半径由大到小的顺序Ca>Mg>C>O.
(6)写出Z单质与B最高价氧化物对应水化物相互反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| A | |||||||||||||||||
| W | T | M | F | ||||||||||||||
| B | D | Z | J | L | H | V | |||||||||||
| C | E | G | Q | ||||||||||||||
(2)属于过渡元素的是G(填字母),H在周期表中的位置第三周期第ⅥA族.
(3)某元素二价阳离子的核外有10个电子,该元素是镁(填元素名称)
(4)L、M、T形成的气态氢化物化合物稳定性由强到弱的顺序H2O>NH3>PH3,J、L、H的最高价氧化物对应水化物的酸性由强到弱的顺序H2SO4>H3PO4>H2SiO3.
(5)D、M、W、E原子半径由大到小的顺序Ca>Mg>C>O.
(6)写出Z单质与B最高价氧化物对应水化物相互反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
 .
.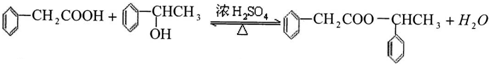 ;该反应类型是酯化反应(或取代反应).
;该反应类型是酯化反应(或取代反应).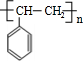 .
.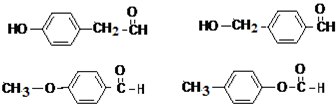 任意一种.
任意一种.