题目内容
5.2009年的诺贝尔物理奖得主之一--美籍华裔物理学家高锟被誉为“光纤之父”,光导纤维的使用,让人们的生活更加丰富多彩.光导纤维是由下列哪种物质经特殊工艺制成的( )| A. | 碳 | B. | 石英 | C. | 锗 | D. | 硅 |
分析 光导纤维的主要成分是二氧化硅,是玻璃、石英、沙子的成分,据此解答.
解答 解:石英的主要成分是二氧化硅,二氧化硅是光导纤维的主要成分,
故选:B.
点评 本题考查了二氧化硅的应用以及物质的组成知识,明确二氧化硅的性质及各物质的主要成分是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
11.下列离子方程式书写不正确的是( )
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
12.分子式为C10H14的二取代芳烃,其可能的结构有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 10种 |
13.为验证氧化性Cl2>Fe3+>SO2,某小组用如图1所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
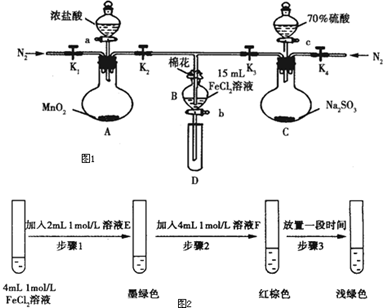
实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.
10.已知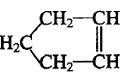 可简写为
可简写为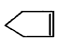 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: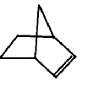
则降冰片烯不具有的性质( )
 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为:
则降冰片烯不具有的性质( )
| A. | 易溶于水 | B. | 能发生氧化反应 | C. | 能发生加成反应 | D. | 能发生取代反应 |
17.下列物质不能发生消去反应的是( )
| A. | 2-丙醇 | B. | 2,2-二甲基-1-丙醇 | ||
| C. | 溴乙烷 | D. | 2-甲基-1-丙醇 |
14.下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:(除特别注明外,其它一律用化学式表示)
(1)化学性质最不活泼的单质是Ne,最高价氧化物水化物中碱性最强的是KOH.
(2)属于过渡元素的是G(填字母),H在周期表中的位置第三周期第ⅥA族.
(3)某元素二价阳离子的核外有10个电子,该元素是镁(填元素名称)
(4)L、M、T形成的气态氢化物化合物稳定性由强到弱的顺序H2O>NH3>PH3,J、L、H的最高价氧化物对应水化物的酸性由强到弱的顺序H2SO4>H3PO4>H2SiO3.
(5)D、M、W、E原子半径由大到小的顺序Ca>Mg>C>O.
(6)写出Z单质与B最高价氧化物对应水化物相互反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| A | |||||||||||||||||
| W | T | M | F | ||||||||||||||
| B | D | Z | J | L | H | V | |||||||||||
| C | E | G | Q | ||||||||||||||
(2)属于过渡元素的是G(填字母),H在周期表中的位置第三周期第ⅥA族.
(3)某元素二价阳离子的核外有10个电子,该元素是镁(填元素名称)
(4)L、M、T形成的气态氢化物化合物稳定性由强到弱的顺序H2O>NH3>PH3,J、L、H的最高价氧化物对应水化物的酸性由强到弱的顺序H2SO4>H3PO4>H2SiO3.
(5)D、M、W、E原子半径由大到小的顺序Ca>Mg>C>O.
(6)写出Z单质与B最高价氧化物对应水化物相互反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
15.下列化合物中含有离子键的是( )
| A. | CO2 | B. | NaCl | C. | CH4 | D. | H3PO4 |